





所属成套资源:2023版高考化学一轮总复习课件
2023版高考化学一轮总复习第五章第一节硫及其化合物课件
展开
这是一份2023版高考化学一轮总复习第五章第一节硫及其化合物课件,共60页。
[自主测评]1.易错易混辨析(正确的画“√”,错误的画“×”)。(1)给定条件下,能实现一步转化:
(2)将某气体通入品红溶液中,品红褪色,则该气体一定是
(3)向久置的 Na2SO3 溶液中加入足量 BaCl2 溶液,出现白色沉淀,再加入足量稀盐酸,部分沉淀溶解,则部分 Na2SO3 被氧
(4)常温下,将铁片浸入足量浓硫酸中,铁片不溶解,则常
温下,铁与浓硫酸一定没有发生化学反应。((5)稀硫酸和铜粉反应可制备硫酸铜。(
SO2,产物只有SO2。
错因:SO2、Cl2 均能使品红溶液褪色,只是漂白原
错因:常温下,铁与浓硫酸反应生成致密氧化物,
错因:稀硫酸氧化性很弱,不能和铜粉反应。
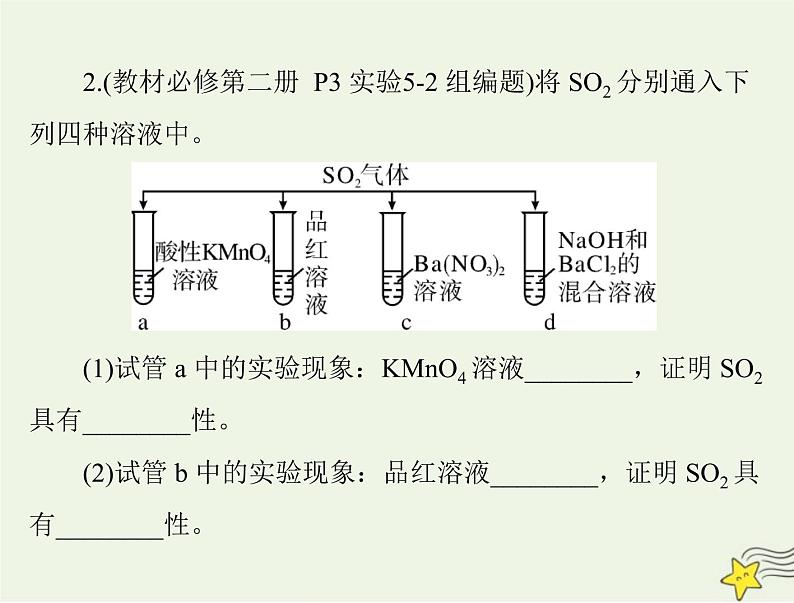
2.(教材必修第二册 P3 实验5-2 组编题)将 SO2 分别通入下
(1)试管 a 中的实验现象:KMnO4 溶液________,证明 SO2
具有________性。
(2)试管 b 中的实验现象:品红溶液________,证明 SO2 具
有________性。
(3)试管 c 中能产生白色沉淀,该沉淀是________。(4)试管 d 中能产生白色沉淀,该沉淀是________。
从 S 元素的化合价角度认识硫单质的氧化性和还原性:
(1)物理性质(2)化学性质
2NaOH+SO2===Na2SO3+H2O
NaOH+SO2===NaHSO3
②弱氧化性(S:+4→0 价):
SO2 与 H2S 反应的化学方程式为_____________________
____________________________。
③强还原性(S:+4→+6 价):
SO2+2H2S===3S↓+2H2O
(3)实验室制法①固体 Na2SO3 与较浓硫酸反应Na2SO3+H2SO4===Na2SO4+SO2↑+H2O;②铜与浓硫酸混合加热
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O。
(4)SO2 对大气的污染与防治
(1)SO2 只能使紫色的石蕊溶液变红,但不能使之褪色。(2)SO2 能使溴水、酸性KMnO4 溶液褪色,体现了SO2 的还
(3)单质硫燃烧时,产物只能是SO2,无论O2 的量是否充足,
(4)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进
行处理(Hg+S==HgS)。
(5)实验室中,残留在试管内壁上的硫可用CS2 溶解除去,
也可用热的NaOH 溶液除去。
(6)三氧化硫在标准状况下是固体,在通常状况下是液体,但是在二氧化硫氧化条件下生成的三氧化硫为气体。
下列叙述中不能说明这一事实的是(
【练1】(2021 年石家庄模拟)硫的氧化性不如氧气强,在
SO2,O2 是氧化剂、S 是还原剂
B.S 是淡黄色固体,O2 是无色气体C. 氢硫酸放置在空气中易变浑浊 (2H2S +O2===2S↓ +2H2O)D.S 和 Cu 反应只能生成 Cu2S(硫化亚铜),而O2 与Cu反应生成 CuO
解析:A 项,S 与 O2 化合时,O2 做氧化剂,硫做还原剂,说明氧气的氧化性比硫强;B 项,不同单质的氧化性强弱与单质的存在状态无必然联系;C 项,氢硫酸放置在空气中易变浑浊,是氧气将硫置换出来,说明氧气的氧化性比硫强;D 项,S 可以将 Cu 氧化生成 Cu2S(Cu 的化合价为+1),而 O2 可以将Cu 氧化为 CuO(Cu 的化合价为+2),说明氧气的氧化性比硫强。
【练 2】(2021 年长沙雅礼中学月考)某化学兴趣小组为探
究SO2 的性质,按下图所示装置进行实验。
(1)装置 A 中盛放浓硫酸的仪器名称是________,其中发生反应的化学方程式为_________________________________________________________________________________________。(2)实验过程中,装置 B 中发生的现象是_____________________________________________________________________,装置 C 中观察到产生淡黄色浑浊现象,此时说明 SO2 具有的性质是________;装置 B 中发生反应的离子方程式为______________________________________________________________。
解析:(1)装置 A 中,将分液漏斗中的浓硫酸加入烧瓶中与亚硫酸钠反应,制得 SO2,反应的化学方程式为 Na2SO3+H2SO4(浓)===Na2SO4+H2O+SO2↑。
(2)将生成的 SO2 气体依次通入 KMnO4 溶液、Na2S 溶液和品红溶液检验 SO2 性质。装置 B 中酸性高锰酸钾溶液紫色褪去,高锰酸根离子被还原为无色的锰离子,证明 SO2 具有还原性;二氧化硫与硫化钠发生反应生成了单质硫,二氧化硫中硫元素的价态降低,因此装置 C 中 Na2S 溶液中出现黄色浑浊,证明SO2 具有氧化性;装置 D 中品红溶液褪色,加热后又恢复红色,证明 SO2 具有漂白性。
Na2SO3+H2SO4(浓)===Na2SO4+H2O+
5SO2 + 2H2O +
(1)SO2 造成的褪色现象分类
①酸性氧化物:使滴有酚酞的NaOH 溶液
②漂白性:使品红溶液褪色
③还原性:使氯水、溴水、碘水、酸性高锰酸钾
(2)三类漂白剂的区别
SO2 与CO2 的性质比较
【练3】(2021年长春十一高月考)选用如图所示仪器中的两个或几个(内含物质)组装成实验装置,以验证木炭可被浓硫
酸氧化成 CO2,下列说法正确的是(
A.按气流从左向右流向,连接装置的正确顺序是 A→F→E
B.丁中溶液褪色,乙中溶液变浑浊,说明甲中生成 CO2C.丙中品红溶液不褪色,乙中溶液变浑浊,说明甲中生成
D.丁和丙中溶液都褪色,乙中溶液变浑浊,说明甲中有CO2
解析:木炭和浓硫酸反应生成二氧化硫、二氧化碳、水,验证木炭可被浓硫酸氧化成 CO2,应先用高锰酸钾溶液除去二氧化硫,再用品红溶液证明二氧化硫已经除尽,最后用澄清石灰水检验二氧化碳气体,导气管长进短出,按气流从左向右流向,连接装置的正确顺序是 A→F→E→C→D→B,A 错误;丙溶液不褪色,乙中溶液变浑浊,说明甲中生成 CO2,B 错误;丙中品红溶液不褪色,说明二氧化硫已除尽,乙中溶液变浑浊,说明甲中生成 CO2,C 正确;丁和丙中溶液都褪色,说明二氧化硫未除尽,乙中溶液变浑浊,不说明甲中有 CO2 生成,D 错误。
【练4】(2020 年韶山第一中学模拟)下列实验中能证明某
气体为 SO2 的是(
②使湿润的蓝色石蕊试纸变红
④通入足量 NaOH 溶液中,再滴加 BaCl2
溶液,有白色沉淀生成,该沉淀溶于稀盐酸
能使溴水褪色,再滴加 Ba(NO3)2 溶液有白色沉淀产生
B.都不能证明D.只有⑤能证明
A.都能证明C.③④⑤均能证明答案:D
[归纳提升] 检验 SO2 和 CO2 同时存在的一般流程
(1)A—检验混合气体中SO2 的存在;现象是品红溶液褪色。B—除去混合气体中的SO2;现象是酸性 KMnO4 溶液颜色
C—检验混合气体中SO2 是否除尽;现象是品红溶液不褪
D—检验混合气体中CO2 的存在;现象是澄清石灰水变浑
(2)为了简化装置,可将除去SO2 和检验SO2 是否除尽合并为一个装置,用较浓的酸性KMnO4 溶液,现象是酸性KMnO4溶液颜色变浅(不能褪色)。
(3)确定混合气体中含有CO2 的实验现象是装置C 中的品红
溶液不褪色,装置D 中澄清石灰水变浑浊。
硫酸及硫酸根离子的检验
考点二1.硫酸的工业制备(1)工艺流程
(2)反应原理①燃烧黄铁矿(FeS2)氧化制备 SO2:
2Fe2O3+8SO2
②SO2 催化氧化为SO3:2SO2+O2
③SO3 被 98.3%的浓 H2SO4 吸收生成 H2SO4:SO3+H2O===H2SO4。
硫酸是一种无色、黏稠的油状液体,密度比水大。浓硫酸溶于水放出大量的热,浓硫酸稀释的方法是____________________________________________________。
壁慢慢注入水中,并用玻璃棒不断搅拌
NH3、H2S、HI
Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
(2)原理解释:先加稀盐酸的目的是________________________________________________,再加 BaCl2 溶液,观察有白色沉淀产生,在此过程中可能发生反应的离子方程式:____________________________、________________________、_________________________、_______________________。
Ag++Cl-===AgCl↓
(1)由“量变”引起的“质变”:金属与浓硫酸反应时,要注意H2SO4 浓度对反应产物的影响。开始阶段产生SO2 气体,随着反应的进行,H2SO4 的浓度变小,最后变为稀硫酸,不活泼金属如Cu 与稀硫酸不反应,活泼金属如Zn 与稀硫酸反应生成H2 而不是SO2。
(2)几种常见的硫酸盐
图如下。下列说法不正确的是(
【练1】(2021 年浙江月考)硫酸是重要的化工原料,可用于生产化肥、农药、炸药等,工业上一般以硫黄或其他含硫矿物如黄铁矿(主要成分 FeS2)为原料制备硫酸,其制备原理示意
A. 用黄铁矿燃烧生成 SO2 的化学方程式为 4FeS2 +11O2
B.SO2 氧化成 SO3 时,加催化剂能使 SO2 全部转化为 SO3C.用 98.3%的浓硫酸吸收 SO3,目的是防止形成酸雾,以使
D.为减少 SO2 对大气的污染,可选用 CaO 做固硫剂把尾气
中的 SO2 以盐的形式固定
解析:用黄铁矿燃烧生成 SO2 的同时,还能生成铁的氧化
物,故其燃烧的化学方程式是 4FeS2+11O2
2Fe2O3+8SO2,
A 正确;SO2 氧化成 SO3 时,其反应是个可逆反应,加催化剂只是改变反应速率,并不能提高转化率,另外可逆反应的转化不可能是全部,B 不正确;吸收 SO3 不能用水,用水会生成酸雾,会阻碍 SO3 的吸收,故工业制硫酸用 98.3%的浓硫酸吸收SO3,目的是防止形成酸雾,以使 SO3 吸收完全,C 正确;为减少 SO2 对大气的污染,可选用 CaO 与 SO2 反应生成亚硫酸钙,然后亚硫酸钙被氧化成硫酸钙,D 正确。答案:B
【练2】(2021 年广州、深圳学调联盟调研)某同学按如图所示实验装置探究铜与浓硫酸的反应,记录实验现象如表。
A.②中白色沉淀是 BaSO3B.①中可能有部分浓硫酸挥发了C.为了确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡D.实验时若先往装置内通入足量 N2,再加热试管①,实验现象不变
解析:实验探究铜与浓硫酸的反应,装置①为反应装置,溶液仍为无色,原因可能是混合体系中水太少,无法电离出铜离子,有白雾说明有气体液化的过程,同时产生白色固体,该固体可能是无水硫酸铜;试管②、③中有白色沉淀生成,该沉淀应为硫酸钡,说明反应过程有SO3 生成或者硫酸挥发,③中沉淀较少,说明三氧化硫或挥发出的硫酸消耗完全;试管④中品红褪色说明反应中生成二氧化硫,浸有碱的棉花可以处理尾气。二氧化硫不与氯化钡溶液反应,白色沉淀不可能是 BaSO3,A 错误;根据分析可知①中可能有部分硫酸挥发了,B 正确;
冷却后的试管中仍有浓硫酸剩余,浓硫酸稀释放热,不能将水注入试管,防止发生危险,C 错误;反应过程中 SO3 是氧气将二氧化硫氧化生成,若先往装置内通入足量 N2,体系内没有氧气,则无 SO3 生成,试管②、③中将无沉淀产生,实验现象发生变化,D 错误。
浓硫酸与金属反应的规律
(1)钝化:常温下浓硫酸使Fe、Al 表面快速生成致密氧化膜而阻止反应进一步发生。(2)与活泼金属(如Zn)反应,开始产生SO2,硫酸浓度变小后产生H2。(3)与不活泼金属(如Cu)反应,开始产生SO2(加热),浓度变小后,稀硫酸不再与不活泼金属反应。例如:1 ml Cu与含2 ml H2SO4 的浓硫酸充分反应,生成的SO2 的物质的量小于1 ml。
A.Fe(NO3)2 溶液B.Ba(NO3)2 溶液C.无色溶液D.无色溶液
白色沉淀白色沉淀白色沉淀
解析:A 项,二氧化硫被硝酸氧化为硫酸,加氯化钡一定生成硫酸钡沉淀;B 项,亚硫酸根被硝酸氧化为硫酸根,沉淀也是硫酸钡;C 项,所得沉淀可能是氯化银;D 项,先加过量盐酸无沉淀,再加氯化钡产生的白色沉淀一定是硫酸钡。
【练4】(2021 年云梦黄香高级中学月考)硫酸根离子检验
沉淀溶解,且有气泡产生
不同价态含硫物质的转化
1.自然界中硫元素的存在
Na2SO4·10H2O
2.理顺硫元素的化合价与含硫粒子的氧化性和还原性的关
3.掌握硫及其化合物之间的转化规律
(1)硫元素的化合价相同的物质相互转化,发生非氧化还原
反应,主要试剂是酸、碱、盐、氧化物等。例如,
分别写出反应②、③、④的离子方程式:
②________________________________________;③_________________________________________;④__________________________________________。
(2)硫元素的化合价不同的物质相互转化,发生氧化还原反应,主要试剂是氧化剂和还原剂。当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态,即台阶式升降,可用如图表示:
写出反应③、⑤的化学方程式:
⑤SO2+2H2S===3S↓+2H2O。
含硫化合物之间的相互转化
【练1】(2021 年肇庆测试)部分含硫物质的类别与相应硫
A.物质 a 是一种有臭鸡蛋气味的气体B.a 通入到 c 的水溶液中会生成 bC.盐 g 与盐 f 之间也可能发生反应
D.d 溶液久置于空气中会生成 e,溶液的 pH 增大
解析:硫的氢化物 H2S 是一种有臭鸡蛋气味的气体,A 正确;H2S 通入到 SO2 的水溶液中会生成单质 S,B 正确;NaHSO4与 Na2SO3 可以发生反应,C 正确;H2SO3 溶液久置于空气中会生成 H2SO4,溶液的 pH 减小,D 错误。
【练2】(2021年铜梁一中月考)物质的类别和核心元素的化合价是研究物质性质的两个重要角度。图示是硫及其部分化合物的“价类二维图”,根据图示回答下列问题:
(1)B 的化学式________。
(2)A 的水溶液在空气中放置易产生淡黄色浑浊,写出反应的化学方程式:_____________________________________________________________________________________。(3)若向 Fe2(SO4)3 溶液中通入足量的 SO2,溶液颜色由棕黄色变为浅绿色,写出反应的离子方程式:___________________________________________,反应中做还原剂的是________。(4)D 的浓溶液与铜单质在加热条件下发生反应的化学方程式为________________________________________________,反应中 D 表现酸性和____________。
+4H,反应中二氧化硫中的S的化合价升高,被氧化,
解析:根据物质的类别可知,A 为 H2S、B 为 SO3、C 为Na2SO3、D 为 H2SO4,结合物质的性质分析解答。(1)根据物质的类别可知,B 为氧化物,且 S 的化合价为+6 价,则 B为SO3;(2)A 为 H2S,H2S 的水溶液在空气中放置易产生淡黄色浑浊,是硫化氢被氧气氧化生成了硫,反应的化学方程式为 2H2S+O2==2S↓+2H2O;(3)若向 Fe2(SO4)3 溶液中通入足量的 SO2,溶液颜色由棕黄色变为浅绿色,是铁离子被二氧化硫还原为亚
铁离子,反应的离子方程式为SO2+2Fe3++2H2O==2Fe2++
做还原剂。(4)D 为 H2SO4,浓硫酸与铜单质在加热条件下发生
反 应 的化 学 方程式 为2H2SO4( 浓) +Cu
CuSO4 +2H2O +
SO2↑,反应中 H2SO4 中的 S 部分化合价降低,部分不变,表现了酸性和强氧化性。
(1)同种元素相邻价态的粒子间不发生氧化还原反应,如S和H2S、S 和SO2、SO2 和浓硫酸之间不发生氧化还原反应。(2)当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态,如2Na2S +Na2SO3 +3H2SO4===3Na2SO4 +3S↓+3H2O。
的转化关系如下所示,则下列说法错误的是(
【练3】(2021 年宜昌模拟)甲、乙、丙、丁四种物质之间
A.若甲是 C,则乙可能是 O2B.若甲是 Fe,则乙可能是 Cl2C.若甲是 NaOH 溶液,则乙可能是 SO2D.若甲是 H2S,则乙可能是 O2
解析:若甲是 C,则乙可能是 O2,丙是 CO,丁是 CO2,A 正确;若甲是 Fe,乙是 Cl2,则丙是氯化铁,氯化铁和氯气不反应,B 错误;若甲是 NaOH 溶液,则乙可能是 SO2,丙是亚硫酸钠,丁是亚硫酸氢钠,C 正确;若甲是 H2S,则乙可能是 O2,丙是 S,丁是 SO2,D 正确。
【练4】(2021年烟台月考)在通常情况下,A为固态单质。
根据如图转化关系,回答下列问题:
(1)写出 A~E 的化学式:
A________;B________;C________;D________;E________。
(2)写出下列反应的化学方程式:
①E→C:________________________________________;②C 转化为 D:_____________________________________;③B 转化为 C:_________________________________。解析:固体单质 A 能和氧气反应,也能和氢气反应,说明是非金属单质,根据其氧化产物可继续和氧气反应可判断 A 是S,和氢气反应生成硫化氢,硫化氢燃烧即生成 SO2,硫和氧气反应生成 SO2,SO2 和氧气反应生成三氧化硫,三氧化硫溶于水生成硫酸;浓硫酸在加热的条件下和铜发生氧化还原反应,生成硫酸铜、SO2 和水。
答案:(1)S H2S SO2 SO3
(2)①Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
②2SO2+O2③2H2S+3O2
2SO32SO2+2H2O
[归纳提升] 含硫化合物之间转化的4 条转化链(1)-2 价硫的化合物间的转化
(2)+4 价硫的化合物间的转化
Na2SO3→BaSO3
(3)+6 价硫的化合物间的转化SO3→H2SO4→NaHSO4→Na2SO4→BaSO4(4)氧化还原反应之间的转化
解析:淡黄色沉淀是 S,在反应过程中硫元素由 NaHSO3中的+4 价降低到 0 价,发生还原反应,HSO3 体现氧化性,A不符合题意;酸性高锰酸钾溶液具有强氧化性,与还原性物质反应紫色才会褪去,所以可以证明 Fe3O4 中有还原性物质,即Fe(Ⅱ),B 不符合题意;在该反应中浓硝酸体现氧化性,N 元素化合价降低,生成的产物可能是 NO 或者 NO2,NO 暴露于空气中也会迅速产生红棕色气体,无法证明反应产物,C 符合题意;先变红说明溶液显碱性,证明 NaClO 在溶液中发生了水解,
NaOH+HClO,后来褪色,是因为水解产生了
漂白性物质 HClO,D 不符合题意。答案:C
2.(2021年新高考Ⅰ卷) 工业上以SO2 和纯碱为原料制备无
A.吸收过程中有气体生成B.结晶后母液中含有 NaHCO3C.气流干燥湿料时温度不宜过高D.中和后溶液中含 Na2SO3 和 NaHCO3
解析:根据工艺流程逆向分析可知,以二氧化硫和纯碱为原料,得到结晶成分为 NaHSO3,则母液为饱和 NaHSO3 和过量的二氧化硫形成的亚硫酸,溶液呈酸性,所以加入纯碱进行中和,涉及的反应为:H2SO3+2Na2CO3===Na2SO3+2NaHCO3,NaHSO3 +Na2CO3===Na2SO3 +NaHCO3 ,所以调节 pH 为 8 进行中和后得到 Na2SO3 和 NaHCO3,通入二氧化硫气体进行混合吸 收 , 此 时 吸 收 过 程 中 发 生 反 应 为 : Na2SO3 + SO2 +H2O===2NaHSO3↓,SO2+NaHCO3===CO2+NaHSO3↓,此时会析出大量 NaHSO3 晶体,经过离心分离,将得到的湿料再进
相关课件
这是一份2024年高考化学一轮总复习 第4单元 第3讲 硫及其化合物 课件,共60页。PPT课件主要包含了第3讲硫及其化合物,考点一硫及其氧化物,-2价硫的化合物,非金属,FeS2,CuFeS2,CaSO4·2H2O,黄色晶体,CaSO3,由无色变为红色等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习4.3硫及其化合物课件
这是一份人教版高考化学一轮总复习第5章第1节硫及其化合物课时教学课件,共60页。PPT课件主要包含了环节1课前自主复习,环节2高考热点突破,环节3新情境专项练等内容,欢迎下载使用。








