






所属成套资源:高考专区化学一轮复习PPT课件全套
2023版高考化学一轮复习新题精练第八章水溶液中的离子反应与平衡课件
展开
这是一份2023版高考化学一轮复习新题精练第八章水溶液中的离子反应与平衡课件,共60页。PPT课件主要包含了必备知识新题精练,关键能力强化提升,高频易错高效快攻,题组1水的电离,题组3酸碱中和滴定,考点3盐类的水解,题组盐类的水解平衡,题组1沉淀溶解平衡,疑难点专练,情境创新专练等内容,欢迎下载使用。
考点1 弱电解质的电离平衡
题组1 弱电解质的电离平衡
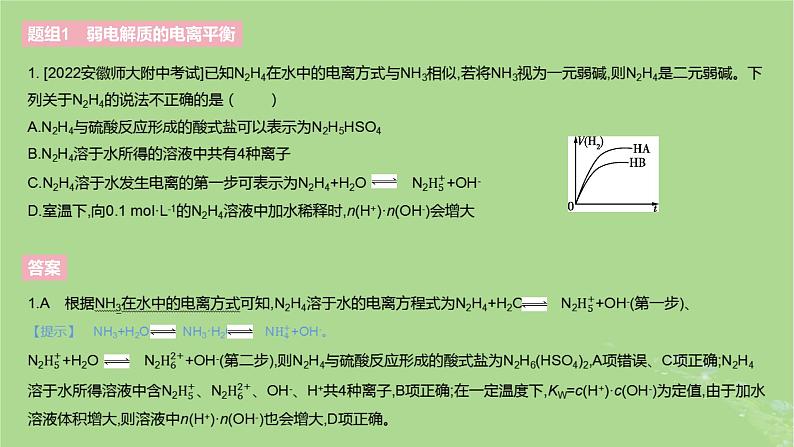
2.[2022山东名校联考]同温同压下,相同体积、相同pH的两种酸HA溶液、HB溶液,分别与足量的锌粉混合,实验测得产生H2的体积(V)随时间(t)的变化如图所示。下列说法错误的是( )A.酸性:HA>HBB.pH相同的两种酸中,c(A-)=c(B-)C.加水稀释到相同pH,HA需要的水多D.用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:HA>HB
2.A 由题图可知,产生氢气的体积:HA>HB,且两溶液的体积、pH均相同,则酸性:HB>HA,A项错误;pH相同的两溶液中c(H+)相同,根据溶液中存在电荷守恒可知c(A-)=c(B-),B项正确;加水稀释能促进弱酸的电离,稀释相同倍数时,HA的pH变化小,要使稀释后pH相同,HA溶液应继续稀释,即稀释HA需要的水较多,C项正确;两溶液pH相同,即起始时c(H+)相同,结合酸性可知电离程度:HAn(HB),因此恰好中和时消耗NaOH溶液的体积:HA>HB,D项正确。
3 .[2022北京东城区检测]电离常数是研究电解质在水溶液中行为的重要工具。现有HX、H2Y和H2Z三种酸,各酸及其盐之间不发生氧化还原反应,它们的电离常数如表所示。下列说法正确的是( )A.在水溶液中结合H+的能力:Y2-HX>HY-。酸性越弱,其对应的酸根离子越容易结合H+,根据酸性HZ->HY-,可知结合H+的能力:Y2->Z2-,A项错误;NaX属于强碱弱酸盐,即NaX溶液中X-发生水解,导致溶液中c(Na+)>c(X-),B项错误;根据酸性:H2Y>HX>HY-,可写出Na2Y溶液与过量HX反应的离子方程式为HX+Y2-=HY-+X-,C项正确;由酸性:H2YH2Z,D项错误。
1.[2022黑龙江八校联考]MOH和ROH是两种一元碱,常温下其水溶液分别加水稀释时,pH变化如图所示。下列说法正确的是( )A.稀释前,c(ROH)=10c(MOH)B.稀释前的ROH溶液与等体积pH=1的硝酸混合后所得溶液显酸性C.等体积、等浓度的MOH溶液和盐酸混合后,溶液中离子浓度大小关系:c(Cl-)>c(M+)>c(OH-)>c(H+)D.在X点时,由H2O电离出的c(H+)相等,c(M+)=c(R+)
1.D【图象分析】 溶液均稀释100倍时,ROH溶液的pH减小2个单位,则ROH是强碱;MOH溶液的pH减小1个单位(小于2个单位),则MOH是弱碱。稀释前, ROH溶液中氢氧根离子的浓度为0.1 ml·L-1,MOH溶液中氢氧根离子的浓度为0.01 ml·L-1,由于弱碱MOH溶液中氢氧根离子的浓度远小于MOH的浓度,则c(ROH)远小于10c(MOH),A项错误; 稀释前的ROH溶液中氢氧根离子浓度为0.1 ml·L-1,等于pH=1的硝酸中氢离子浓度,则二者等体积混合后所得溶液为强酸强碱盐的溶液,显中性,B项错误; 等体积、等浓度的MOH溶液和盐酸混合后所得溶液为强酸弱碱盐MCl的溶液,显酸性,溶液中离子浓度大小关系:c(Cl-)>c(M+)>c(H+)>c(OH-),C项错误;碱抑制水的电离,X点两溶液中氢氧根离子浓度相等,所以抑制水电离的程度相等,X点时,由H2O电离出的c(H+)相等,结合两溶液中电荷守恒 c(M+)+c(H+)=c(OH-)、c(R+)+c(H+)=c(OH-)可知,X点时c(M+)=c(R+),D项正确。
易错点 不能正确分析微粒的分布分数图象而出错
考点2 水的电离和溶液的酸碱性
1. [2022江苏如皋调研]水是最常见的溶剂。下列说法正确的是( )A.水的电离方程式为H2O=H++OH-B.升高温度,水的离子积常数增大C.常温下,由水电离出c(H+)=1×10-12 ml·L-1的溶液呈碱性D.水是非极性溶剂
2. [2022四川凉山州诊断]水的电离平衡曲线如图所示。下列说法正确的是( )A.图中温度T1>T2B.T2温度时,将pH=10的NaOH溶液与pH=3的H2SO4溶液混合, 若混合溶液呈中性,则NaOH溶液与H2SO4溶液的体积比为1∶10C.b点到c点可以通过不改变温度,在水中加入适量的CH3COONa实现D.图中五个点的KW的关系为b>c>a>d=e
题组2 溶液的酸碱性与pH
4. [2022北京石景山区考试]在常温下,有关下列4种溶液的叙述不正确的是( ) A.在溶液①和②中分别加入适量的氯化铵晶体后,两种溶液的pH均减小B.各取1 mL 4种溶液,分别稀释至10 mL,则溶液的pH:①>②>④>③C.将溶液②和③等体积混合,所得溶液中:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)D.将a L 溶液②和b L 溶液④混合后,所得溶液的pH=4,则a∶b=9∶11(忽略溶液体积变化)
5 .[2022云南昆明一中考试]室温下,向20.00 mL 0.100 0 ml·L-1盐酸中滴加0.100 0 ml·L-1NaOH溶液,溶液的pH随NaOH溶液体积的变化关系如图所示(忽略溶液体积变化)。下列说法错误的是( )A.V(NaOH)=16.36 mL时,pH=2B.V(NaOH)=40.00 mL时,c(Cl-)=c(OH-)+c(H+)C.选择甲基橙指示反应终点,误差比甲基红或酚酞的大D.滴定过程中,盐酸中水的电离程度先增大后减小
1 .[2022贵州贵阳摸底]室温下,用0.01 ml·L-1的NaOH溶液滴定10.00 mL 0.01 ml·L-1的CH3COOH溶液,水电离出的c(OH-)随NaOH溶液体积的变化曲线如图所示。下列说法正确的是( )A.P、M、N三点,M点pH最大B.M点溶液显中性,V1=10.00C.该滴定过程选择甲基橙作为指示剂D.N点溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
1.D 随着NaOH溶液的加入,混合溶液的pH逐渐增大,故pH:Pc(HS-)>c(S2-)>c(OH-)>c(H+)B.Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)C.室温下,用NaOH溶液滴定等浓度的NaHS溶液,滴定终点刚好形 成0.1 ml·L-1的Na2S溶液,该过程可以选用酚酞作指示剂D.当c(OH-)=c(S2-)时,c(HS-)≈9.09×10-3 ml·L-1
易错点 混淆“三大守恒”而错判微粒浓度关系
考点3 难溶电解质的溶解平衡
题组2 溶度积及其应用
4. [2022河南名校联考]常温时,CuS的溶度积Ksp=6.3×10-36,NiS在水中的沉淀溶解平衡曲线如图所示。下列有关推断正确的是 ( )A.常温时,CuS在Na2S溶液中的溶解度和Ksp均比在水中的小B.常温时,NiS的溶度积Ksp(NiS)=1.0×10-24C.向含等浓度Cu2+、Ni2+的混合溶液中滴加Na2S溶液,先生成NiS沉淀D.向Y点溶液中加入Na2S溶液,可使Y点移到Z点
2. [2022山东菏泽考试]25 ℃时,M(OH)2和N(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lg c(X2+)]与溶液pOH[-lg c(OH-)]的变化关系如图所示。已知该温度下Ksp[M(OH)2]>Ksp[N(OH)2]。下列说法正确的是( )A.a线表示M(OH)2饱和溶液中的变化关系B.向A点对应的饱和溶液中加入少量NaOH,可转化为B点对应的溶液C.Ksp[N(OH)2]=10-15.1D.当M(OH)2和N(OH)2沉淀共存时,溶液中c(M2+)∶c(N2+)=104.6∶1
易错点 对沉淀溶解平衡的原理理解不清而出错
专项1 溶液中微粒浓度大小关系
1. [2022广东广州调研]HCOOH是最简单的羧酸,俗称蚁酸。下列叙述正确的是( )A.pH=4的HCOOH溶液中,c(H+)=c(HCOO-)B.pH=5的HCOOH和HCOONa混合溶液中,c(HCOO-)>c(Na+)C.0.1 ml·L-1 HCOONa溶液中,c(Na+)>c(OH-)>c(HCOO-)>c(H+)D.0.1 ml·L-1 HCOONa溶液中,c(Na+)=c(HCOO-)+c(OH-)
1.B 由电荷守恒知,HCOOH溶液中c(H+)=c(HCOO-)+c(OH-),A项错误;该混合溶液的pH=5,显酸性,c(H+)>c(OH-),结合电荷守恒c(Na+)+c(H+)=c(HCOO-)+c(OH-)可知,c(HCOO-)>c(Na+),B项正确;0.1 ml·L-1的HCOONa溶液中,HCOO-少部分水解使溶液显碱性,则c(Na+)>c(HCOO-)>c(OH-)>c(H+),C项错误;根据电荷守恒,0.1 ml·L-1的HCOONa溶液中c(Na+)+c(H+)=c(HCOO-)+c(OH-),D项错误。
专项2 中和滴定原理的迁移应用
疑难点 溶液中离子平衡图象的分析
5. [2022甘肃一诊]分析化学中“滴定分数”的定义为:所加滴定剂与被滴定组分的物质的量之比。常温下以0.10 ml·L-1的HCl溶液滴定同浓度某一元碱MOH溶液并绘制滴定曲线如图所示。下列说法不正确的是( )[已知HCOOH的Ka=1.8×10-4,NH3·H2O的Kb=1.8×10-5]A.该酸碱中和滴定过程应该选用甲基橙作指示剂B.x点处的溶液中满足:c(MOH)+c(OH-)
相关课件
这是一份2024届高考化学一轮总复习第八章水溶液中的离子反应与平衡第一节电离平衡课件,共45页。PPT课件主要包含了答案1√,不变但不一定相等,cOH-减小,×10,答案中,-701V-2,液显红色D错误,答案D,答案C,答案B等内容,欢迎下载使用。
这是一份2024届高考化学一轮总复习第八章水溶液中的离子反应与平衡第四节沉淀溶解平衡课件,共51页。PPT课件主要包含了沉淀析出的方向,沉淀溶解的方向,答案B,答案D,答案C等内容,欢迎下载使用。
这是一份2024届高考化学一轮复习课件 第八章 水溶液中的离子反应与平衡 第4讲 沉淀溶解平衡,文件包含第4讲沉淀溶解平衡pptx、第4讲沉淀溶解平衡docx、第4讲沉淀溶解平衡课后作业docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。









