




所属成套资源:高考专区化学一轮复习PPT课件全套
2023版高考化学一轮复习新题精练第九章化学反应与电能课件
展开
这是一份2023版高考化学一轮复习新题精练第九章化学反应与电能课件,共60页。PPT课件主要包含了考点1原电池,必备知识新题精练,题组2化学电源,关键能力强化提升,高频易错高效快攻,考点2电解池,疑难点专练,情境创新专练,提升素养拓展思维,题型专练创新集训等内容,欢迎下载使用。
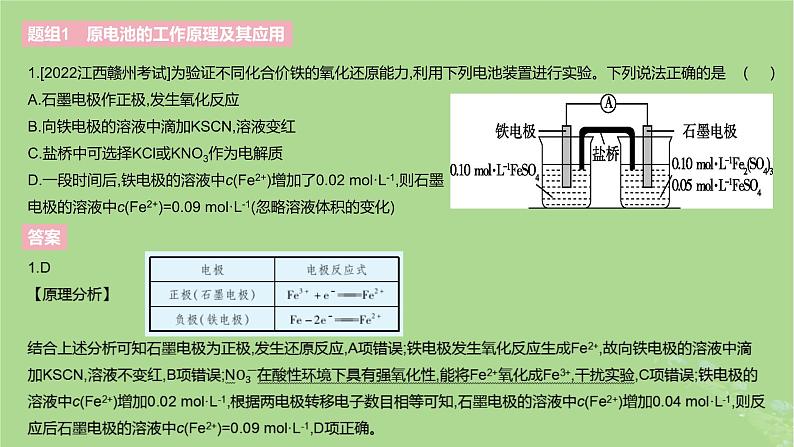
1.[2022江西赣州考试]为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。下列说法正确的是 ( )A.石墨电极作正极,发生氧化反应B.向铁电极的溶液中滴加KSCN,溶液变红C.盐桥中可选择KCl或KNO3作为电解质D.一段时间后,铁电极的溶液中c(Fe2+)增加了0.02 ml·L-1,则石墨电极的溶液中c(Fe2+)=0.09 ml·L-1(忽略溶液体积的变化)
题组1 原电池的工作原理及其应用
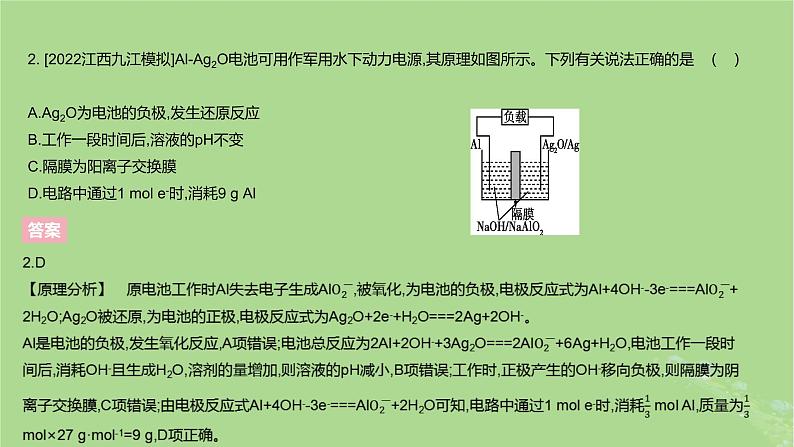
2. [2022江西九江模拟]Al-Ag2O电池可用作军用水下动力电源,其原理如图所示。下列有关说法正确的是 ( )A.Ag2O为电池的负极,发生还原反应B.工作一段时间后,溶液的pH不变C.隔膜为阳离子交换膜D.电路中通过1 ml e-时,消耗9 g Al
3 .[2022广东肇庆模拟]我国科学家在Li-CO2电池的研究上取得重大科研成果。设计分别以金属Li和碳纳米管复合Li2CO3为电极的Li-CO2电池,放电时电池反应为3CO2+4Li===2Li2CO3+C。该电池放电时 ( )
A.Li电极发生还原反应B.Li+在电解质中移向负极C.CO2在正极上得到电子D.电流由Li电极经外电路流向碳纳米管复合Li2CO3电极
1.[2022山东潍坊测评]电极电势的测定常用甘汞电极作为参比电极(部分数据如下)。测定过程中,待测 电极与甘汞电极组成原电池,其工作原理如图。下列说法正确的是( )A.盐桥中Cl-向甘汞电极移动B.若M为Cu,则电极反应式是:Cu-2e-===Cu2+C.甘汞电极的电极反应式是:2Hg+2Cl--2e-===Hg2Cl2D.测定过程中,甘汞电极内部KCl晶体可能增多
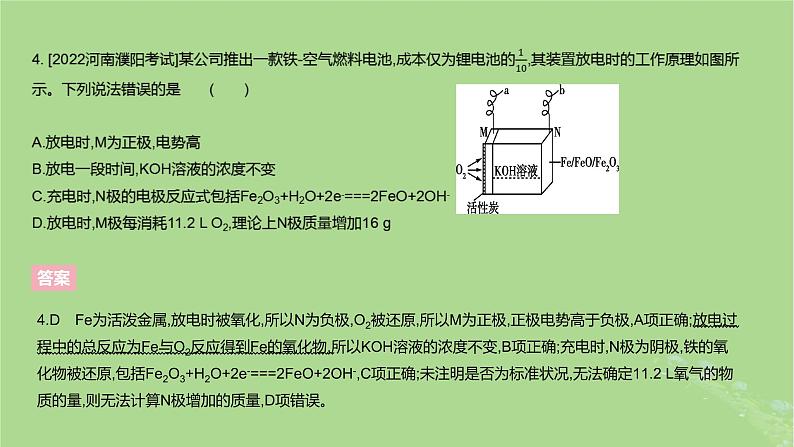
2.[2022河南三地市质检]一种以某固体氧化物为电解质的新型燃料电池的工作原理如图所示。在700~900 ℃时,O2-可在该固体氧化物电解质中自由移动,产物对环境无污染。下列说法正确的是(设NA为阿伏加德罗常数的值) ( )A.若A为氢气,则正极的电极反应式为H2-2e-+O2-===H2OB.若B为氧气,则电极乙的电极反应式为O2+4e-+2H2O===4OH-C.若A为甲烷,则消耗32 g甲烷时,外电路中转移的电子数为16NAD.若A为肼(N2H4),B为氧气,则电池总反应为N2H4+3O2===2NO2+2H2O
2.C 由电子流动方向可知,电极甲为负极,电极乙为正极。若A为氢气,则负极的电极反应式为H2-2e-+O2-===H2O,A项错误;若B为氧气,则电极乙的电极反应式为O2+4e-===2O2-,B项错误;若A为甲烷,则电极甲的电极反应式为CH4-8e-+4O2-===CO2+2H2O,32 g甲烷的物质的量为32 g÷(16 g·ml-1)=2 ml,则电路中转移的电子数为16NA,C项正确;由于产物对环境无污染,则A为肼(N2H4),B为氧气时,产物为氮气和水,电池总反应为N2H4+O2===N2+2H2O,D项错误。
易错点 不能正确判断电化学装置的电极类型而出错
7. [2022重庆诊断]苯酚( )是生产某些树脂、杀菌剂、防腐剂以及药物(如阿司匹林)的重要原料,但苯酚也有较强的毒性。如图是处理废水中苯酚的装置。下列有关说法正确的是 ( )A.a极电势低,电极附近溶液的pH增大B.H+由B区移向A区,B区溶液的pH增大C.b极的电极反应式为WO3+xH++xe-===HxWO3D.若有2 ml电子通过导线,A、B两区域中溶液质量改变量之和为2 g
8. [2022湖南娄底质检](双选)当前各种新型二次电池层出不穷,其中以Fe[Fe(CN)6]为代表的新型可充电钠离子电池格外引人注意,其放电时的工作原理如图所示。下列说法正确的是( )A.放电时,正极的电极反应式为Fe[Fe(CN)6]+2Na++2e-===Na2Fe[Fe(CN)6]B.充电时,M箔接电源的负极C.充电时,右室中Na+浓度减小D.外电路中通过0.2 ml电子时,负极质量的变化量为2.4 g
根据上述分析可知,A项正确;充电时,电解池的阴极(原电池的负极)接电源的负极,电解池的阳极(原电池的正极)接电源的正极,即M箔接电源的正极,B项错误;充电时,阳离子移向阴极,即Na+应从左室移向右室,右室中Na+浓度增大,C项错误;由负极的电极反应式可知,外电路中通过0.2 ml电子时,消耗0.1 ml Mg,负极质量减少2.4 g,D项正确。
1.[2022广东茂名测试]粗银中含有Cu、Pt等杂质,用电解法以硝酸银为电解质提纯银。下列说法正确的是 ( )A.粗银与电源负极相连B.阴极的电极反应式为Ag++e-===AgC.Cu、Pt在阳极区中沉积D.电解液中c(Ag+)先增大后减小
题组 电解池的工作原理及其应用
1.B 电解精炼粗银时,粗银作阳极,应与电源正极相连,A项错误;纯银为阴极,Ag+在阴极被还原为Ag,电极反应式为Ag++e-===Ag,B项正确;阳极中Cu失电子生成Cu2+,Pt为惰性金属形成阳极泥,C项错误;电解粗银时,较活泼的铜失电子形成离子进入溶液,电解液中c(Ag+)不会增大,D项错误。
3. [2022北京海淀区期末]利用固体氧化物电解池可将CO2转化为CO并存储,装置示意图如图所示。下列说法不正确的是( )A.a极连接电源的正极B.a极上的电极反应为O2+4e-===2O2-C.b极上的电极反应为CO2+2e-===CO+O2-D.通过该过程可以实现储能
4. [2022广东深圳调研]利用电化学原理可对海水(主要成分为NaCl和H2O,还含有少量微生物)进行消毒,并能清除残留的含氯消毒物质(工作原理如图,其中电极均为惰性电极)。已知:工作时,先断开K2,闭合K1,一段时间后,断开K1,闭合K2。下列说法不正确的是 ( )A.闭合K1后的总反应为2Cl-+2H2O Cl2↑+H2↑+2OH-B.闭合K2后,Na+通过离子交换膜从Ⅱ室迁移至Ⅲ室C.工作完成后,Ⅱ室中有金属Na剩余D.残留的含氯消毒物质在Ⅲ室放电被脱除
4.A 闭合K1后为电解池,阳极区海水中的Cl-被氧化为氯气,阴极区为含Na+的有机电解液,Na+被还原生成Na单质,总反应为2Cl-+2Na+ Cl2↑+2Na,A项错误。闭合K2后为原电池,Ⅱ室中Na单质被氧化为Na+,Ⅱ室中电极为负极,Ⅲ室中电极为正极,原电池中阳离子移向正极,所以Na+通过离子交换膜从Ⅱ室迁移至Ⅲ室,B项正确。闭合K1时在Ⅰ室生成的氯气与水反应生成HClO(含氯消毒物质),假设此过程生成1 ml氯气,则最多生成1 ml HClO,根据电子守恒可知生成2 ml钠单质;HClO可以氧化微生物,进行消毒,未反应的HClO在闭合K2后的Ⅲ室中被还原脱除,由于部分HClO是被微生物还原的,所以在Ⅲ室中被还原的HClO的物质的量小于1 ml,则Ⅱ室中消耗的钠单质小于2 ml,所以有金属Na剩余,C、D项正确。
5. [2022安徽名校联考]我国科研团队报道了一种通用而有效的策略,利用非贵金属催化剂,以相当低的电耗在水性电解质中将CO2和甲醇都转化为附加值产品甲酸。下列说法错误的是 ( )A.碳布上的介孔SnO2(mSnO2/CC)作阴极催化剂B.本策略对于减少温室效应和有效利用二氧化碳具有重要意义C.中间隔膜为质子交换膜,工作一段时间后阴极区和阳极区pH都会降低D.电路中通过4 ml电子时,生成2 ml甲酸
1.B【原理分析】 由B极放出H2可知,B极发生还原反应,即电极B为阴极,电极A为阳极。电极B是阴极,该装置工作时,阳离子向阴极(电极B)移动,A项正确;结合电极B是阴极,可知b极为电源的负极,则a极为电源的正极,B项错误;由上述分析可知,C项正确;质子交换膜只允许H+通过,根据电荷守恒可知,当转移2 ml电子时,有2 ml H+通过质子交换膜,D项正确。
2. [2022山东青岛质检]微生物电化学产甲烷法是将电化学法和生物还原法有机结合,装置如图所示[其中电源为(CH3)2NNH2-KOH-O2清洁燃料电池]。下列说法正确的是( )A.氢离子可通过离子交换膜自右室移向左室B.温度越高,产甲烷效率越高C.电源放电过程中会产生N2D.a电极反应为CH3COO--6e-+2H2O===2CO2↑+7H+
3. [2022河南郑州二测]钛铁合金具有优异的性能,在航天和生物医学等领域有广泛的应用。如图是以二氧化钛、氧化亚铁混合粉末压制的块体和石墨坩埚分别作电极材料,以CaCl2熔盐(不参与电极反应)为离子导体制备钛铁合金的电解装置示意图。下列相关说法正确的是 ( )A.石墨坩埚连接直流电源的负极B.通入Ar主要是为了保护石墨坩埚不被氧化C.TiO2发生的电极反应为TiO2-4e-===Ti+2O2-D.每生成16.0 g TiFe2时,流出气体在标准状况下的体积大于4.48 L
3.D【电池分析】 TiO2和FeO发生还原反应生成钛铁合金,则该电极为阴极,连接电源负极,石墨坩埚电极为阳极,连接电源正极。由上述分析知,A项错误,C项错误;Ar为不活泼气体,通入Ar可排除装置内阳极产生的O2,主要目的是防止生成的Ti和Fe被氧化,B项错误;根据电极反应式可知,每生成16.0 g即0.1 ml TiFe2,转移0.8 ml电子,理论上阳极生成0.2 ml O2,其在标准状况下的体积为4.48 L,但阳极上会发生反应2C+O2===2CO,从而造成流出气体的体积增大,D项正确。
6. [2022长沙一中、深圳实验学校联考](双选)某课外活动小组用如图所示装置进行实验(电解液足量)。下列说法正确的是 ( )A.图2中若开始实验时开关K与a连接,电解液中AgNO3的浓度保持不变B.图1中若开始实验时开关K与b连接,一段时间后向电解液中加入适量稀盐酸 可使电解液恢复到电解前的浓度C.图1中若开始实验时开关K与a连接,B极的电极反应式为Fe-2e-===Fe2+D.图2中若开始实验时开关K与b连接,A极减少的质量等于B极增加的质量
6.CD【解题关键】 图1和图2中,开关K接a时形成原电池,接b时形成电解池。所形成的原电池中左侧电极均为正极,右侧电极均为负极;所形成的电解池中左侧电极均为阳极,右侧电极均为阴极。图2中若开始实验时开关K与a连接,形成原电池,电池总反应式为Fe+2AgNO3===Fe(NO3)2+2Ag,导致电解液中AgNO3的浓度减小,A项错误;图1中若开始实验时开关K与b连接,形成电解池,电解的总反应式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,由质量守恒可知一段时间后向电解液中通入适量HCl可使电解液恢复到电解前的浓度,B项错误;图1中若开始实验时开关K与a连接,则形成原电池,B极的电极反应式为Fe-2e-===Fe2+,C项正确;图2中若开始实验时开关K与b连接,相当于电镀装置,即A极减少的质量等于B极增加的质量,D项正确。
易错点 不能正确分析“多室”电解池而出错
7. [2022浙江宁波模拟]某锂离子电池的总反应为2Li+FeS===e+Li2S。某小组以该电池为电源电解处理含Ba(OH)2废水和含Ni2+、Cl-的酸性废水,并分别获得BaCl2溶液和单质镍。电解处理的工作原理如图所示[已知LiPF6·SO(CH3)2为锂离子电池的电解质]。下列说法正确的是 ( )A.X与锂离子电池的Li电极相连B.若去掉离子膜M将a、b两室合并,则X电极的反应不变C.离子膜M为阴离子交换膜,离子膜N为阳离子交换膜D.电解过程中b室BaCl2浓度增大
7.D【原理分析】 该锂离子电池中Li发生氧化反应作负极,FeS发生还原反应,作正极。结合电解后获得BaCl2溶液和单质镍,可知镍棒上发生Ni2++2e-===Ni,即镍棒Y为阴极;碳棒X为阳极,电极反应式为4OH--4e-===O2↑+2H2O,a室中Ba2+进入b室中生成BaCl2。根据上述分析可知,阳极X应与锂离子电池的正极(FeS)相连,A项错误。阳极的电极反应式为4OH—4e-===O2↑+2H2O,若去掉离子膜M将a、b两室合并,由于阴离子放电顺序:Cl->OH-,故阳极的电极反应式为2Cl--2e-===Cl2↑,即X电极的反应发生改变,B项错误。镍棒与电源负极相连,电极反应式为Ni2++2e-===Ni,为平衡电荷,Cl-移向b室,即N为阴离子交换膜;同理,为平衡电荷Ba2+移向b室,即M为阳离子交换膜,C项错误。结合上述分析可知,电解过程中b室中Ba2+、Cl-浓度均增大,即b室中BaCl2的浓度增大,D项正确。
8. [2022江西吉安期末]氢碘酸(HI)可用“四室电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列叙述错误的是 ( )A.阳极的电极反应式为2H2O-4e-===4H++O2↑B.得到1 ml HI产品,阳极室溶液质量减少8 gC.通电过程中,原料室中NaI溶液的浓度逐渐减小D.该法在制备HI时可以得到NaOH产品
8.B【解题关键】 结合图示装置可知左侧石墨电极与电源正极相连,为电解池的阳极,右侧石墨电极与电源负极相连,为电解池的阴极。原料室中I-通过阴膜进入产品室,阳极室中的H+通过阳膜进入产品室,得到HI溶液;原料室中的Na+通过阳膜进入阴极室得到NaOH溶液。阳极上H2O发生氧化反应生成O2,其电极反应式为2H2O-4e-===4H++O2↑,A项正确;得到1 ml HI产品时,电路中转移1 ml电子,阳极室产生0.25 ml O2,其质量为8 g,另有1 ml H+通过阳膜进入产品室,导致溶液质量共减少9 g,B项错误;通电过程中,原料室中的Na+移向阴极室,I-移向产品室,故NaI溶液的浓度逐渐减小,C项正确;阴极的电极反应式为2H2O+2e-===2OH-+H2↑,同时原料室中Na+移向阴极,可以得到NaOH产品,D项正确。
考点3 金属的腐蚀与防护
题组 金属的腐蚀与防护
1. [2022广东测评]研究金属的腐蚀和防护有利于降低国家的经济损失,具有现实意义。下列有关做法与防护原理不匹配的是 ( )
1.D 在护栏表面涂上环氧封闭涂料,目的是隔绝钢铁与腐蚀介质(空气、水)接触,A项不符合题意;用浓硝酸对铁罐车内壁进行酸洗,Fe与浓HNO3发生钝化反应,在铁罐车内壁产生致密氧化膜,隔绝金属与酸而起到保护作用,B项不符合题意;采用铝锂合金,是通过改变金属的本质,使其具有抗腐蚀性,C项不符合题意;将钢铁闸门与电源连接,此方法为外加电流法,需将钢铁闸门与电源负极连接从而起到保护作用,D项符合题意。
2. [2022河北名校联考]点蚀又称为孔蚀,是一种集中于金属表面很小的范围并深入到金属内部的腐蚀形态。某铁合金钝化膜破损后的孔蚀如图所示,下列说法正确的是 ( )A.为防止孔蚀的发生可以将外接电源正极与金属相连B.孔蚀外每吸收2.24 L O2,可氧化0.2 ml FeC.孔蚀中Fe3+水解导致电解质溶液酸性增强D.孔隙中可以发生析氢腐蚀
1.[2022上海奉贤区考试]将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。下列有关说法正确的是 ( )A.钢铁设施的电极反应式为Fe-2e-===Fe2+B.该方法为牺牲阳极法,活泼的金属M作正极C.钢铁设施表面因有电子流入而被保护D.通常情况下,钢铁设施在河水中的腐蚀速率比在海水中的快
2. [2022重庆质检]文物保护讲究“修旧如旧”。古代青铜器铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3 和Cu2(OH)3Cl。青铜器在潮湿环境中发生电化学腐蚀生成Cu2(OH)3Cl的原理示意图如图所示。已知CuCl是白色不溶于水的固体,下列说法正确的是 ( )A.疏松的Cu2(OH)3Cl属于无害锈B.过程Ⅰ中负极的电极反应式为Cu-e-===Cu+C.若生成2.145 g Cu2(OH)3Cl,理论上消耗标准状况下氧气的体积为0.224 LD.用HNO3溶液除青铜器上的铜锈,可实现“修旧如旧”,保护文物的艺术价值
专项1 电极反应式的书写
1.D 【原理分析】综上分析可知,Ni-C/Ni极为负极,Pd/CFC极为正极,负极的电势比正极的低,A项正确。负极区的K+通过阳离子交换膜迁移至正极区,正极区得到的产物为K2SO4,B项正确。由分析可知,C项正确。判断电极上发生的反应需要考虑电解质溶液的酸碱性,正极区的电解质溶液显酸性,不可能生成OH-,D项错误。
2. [2022山东枣庄考试]2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。某高能锂离子电池的总反应为Li1-xCO2+LixC6 LiCO2+C6(xaB.阴极电极反应式为C2H5OH+Cl--2e-===C2H5OCl+H+C.电解后溶液的pH会减小(忽略溶液体积变化)D.每产生1 ml H2需要消耗3 ml C2H5OH
3.D【原理分析】 电解池中阳极发生氧化反应,阴极发生还原反应,由电解装置图可知,催化电极a为阳极,其电极反应式为C2H5OH+Cl--2e-===C2H5OCl+H+,催化电极b为阴极,其电极反应式为2H++2e-===H2↑,在电解液中发生反应C2H5OCl CH3CHO+Cl-+H+、CH3CHO+2C2H5OH C6H14O2+H2O,该装置内的总反应为3C2H5OH C6H14O2+H2O+H2↑。催化电极a为阳极,催化电极b为阴极,阳极的电极电势高于阴极,A项错误;阳极电极反应式为C2H5OH+Cl--2e-===C2H5OCl+H+,B项错误;由总反应3C2H5OH C6H14O2+H2O+H2↑可知,电解后溶液的pH不会减小,且每产生1 ml H2,共消耗3 ml C2H5OH,C项错误,D项正确。
专项2 电化学的有关计算
1.[2022河北邢台四校联考]微生物脱盐池是在微生物燃料电池的基础上发展而来的新兴的生物电化学系统,通过阴阳离子交换膜的使用,可以实现盐分的高效去除,从海水中得到淡水,同时去除有机物,而且无需额外的能量输入,具有广阔的应用前景。如图是一种微生物脱盐池的装置,下列有关说法正确的是 ( )A.该装置可以在高温下工作B.X为阳离子交换膜,Y为阴离子交换膜C.负极反应为CH3COO-+8e-+2H2O===2CO2↑+7H+D.当负极产生11 g CO2时,海水(不考虑NaCl以外的溶质)理论上除盐58.5 g
1.D 高温能使微生物蛋白质凝固变性,导致电池无法工作,故该装置不能在高温下工作,A项错误。原电池中,阳离子Na+移向正极、阴离子Cl-移向负极,从而达到除盐的目的,所以Y为阳离子交换膜、X为阴离子交换膜,B项错误。负极发生氧化反应,电极反应式为CH3COO-+2H2O-8e-===2CO2↑+7H+,C项错误。负极产生11 g (0.25 ml) CO2时,转移1 ml电子,则理论上有1 ml Na+和1 ml Cl- 发生定向移动,故海水理论上除盐58.5 g,D项正确。
2.[2022天津和平区期末]以对硝基苯甲酸( )为原料,采用电解法合成对氨基苯甲酸( )的装置如图所示。下列说法正确的是 ( )A.电子由铅合金经溶液流向金属阳极DSAB.阴极的主要电极反应式为 +6e-+6H+=== +2H2OC.每转移1 ml电子,阳极电解质溶液的质量减少8 gD.反应结束后阳极区pH增大
2.B 电子只能在导线中流动,不会进入溶液,A项错误。铅合金电极上有机物放电,硝基转化为氨基,发生还原反应,铅合金电极作阴极,电极反应式为 ,B项正确。阳极反应式为2H2O-4e-===4H++O2↑,每转移1 ml电子,生成0.25 ml O2,同时有1 ml H+ 移向阴极,故阳极电解质溶液的质量减少 0.25 ml×32 g·ml-1+1 ml×1 g·ml-1=9 g,C项错误。根据阳极反应式可知,反应过程中消耗水,反应结束后阳极区H+浓度增大,pH减小,D项错误。
3. [2022江西五校联考]我国科研团队开发了一种新型铠甲催化剂Ni/C@石墨烯,可以高效去除合成气中的H2S杂质并耦合产氢,其工作原理如图所示。下列说法错误的是 ( )A.铠甲催化剂电极上的电势高于M电极上的电势B.阴极的电极反应式为2H++2e-=== H2↑C.通电后,阳极区溶液的pH降低D.生成H2和Sx的物质的量之比为1∶x
3.D 由图中信息知,铠甲催化剂电极为阳极,M电极为阴极,阳极上的电势高于阴极上的电势,A项正确;阴极上氢离子得电子产生H2,电极反应式为2H++2e-=== H2↑,B项正确;阳极区H2S反应生成Sx和H+,故阳极区溶液的pH减小,C项正确;阴极上生成1 ml H2得到2 ml电子,阳极上生成1 ml Sx失去2x ml电子,由得失电子守恒知,生成H2和Sx的物质的量之比为x∶1,D项错误。
4. [2022浙江台州考试]氯碱工业是高耗能产业,将电解池与燃料电池串联组合的新工艺可节能,装置如图所示。已知:空气中氧气的体积分数为20%。下列叙述错误的是 ( )A.X为Cl2,Y为H2B.c>a>bC.标准状况下,若生成22.4 L X,则消耗空气56 LD.燃料电池中阳离子的移动方向是从右侧移向左侧
4.DC项,根据得失电子守恒可得关系式:2Cl2~2H2~O2,n(O2)=0.5n(Cl2)=0.5 ml,所以n(空气)=5n(O2)=2.5 ml,则标准状况下,V(空气)=2.5 ml×22.4 L·ml-1=56 L,正确。
疑难点 新情境下电化学装置的分析
1.[2022重庆西南大学附属中学测试]2-萘酚( )为一种环境污染物,可采用催化剂(Ag@AgBr/mp-TiO2)光降解法除去该污染物,工作原理如图所示。下列说法正确的是 ( )A.该方法中的能量转化只有化学能转化为电能B.O2在正极失电子,mp-TiO2可增大O2的失电子速率C.用该方法降解1 ml 2-萘酚时,需要消耗11.5 ml O2D.负极的电极反应式为 -46e-+46OH-===10CO2↑+27H2O
1.C 由题图可知,太阳能参与了该降解过程,即还存在太阳能转化为化学能的能量转化,A项错误。O2在该装置中得电子生成O2-,mp-TiO2为催化剂,可增大O2的得电子速率,B项错误。a电极发生还原反应,作正极,电极反应式为O2+4e-===2O2-,b电极作负极,发生氧化反应,电解质中传导的是O2-,故电极反应式为-46e-+23O2-===【技法】 该电池为燃料电池,也可直接根据“通入O2的电极为正极,通入燃料的电极为负极”进行判断。10CO2↑+4H2O,根据正、负极转移电子数相等可得关系式: ~46e-~11.5O2,故降解1 ml 2-萘酚时,需要消耗11.5 ml O2,C项正确、D项错误。
4. [2022湖南株洲二中测试]天津大学研究团队以KOH溶液为电解质溶液,CP和Ni2P纳米片为催化电极材料,电催化合成偶氮化合物的装置如图所示(R代表烃基)。下列说法正确的是 ( )A.若用铅蓄电池作为电源,则Ni2P极连接铅蓄电池的Pb极B.CP极的电极反应式为2 +8e- + 8H+=== +4H2OC.合成1 ml偶氮化合物,要消耗2 ml RCH2NH2D.离子交换膜是阳离子交换膜
4.C铅蓄电池的Pb极为负极,连接电解池的阴极,即CP极,A错误。根据电极反应式可知,合成1 ml偶氮化合物转移8 ml电子,要消耗2 ml RCH2NH2,C正确。由两极的电极反应式可知,左侧电极消耗OH-,右侧电极生成OH-,为使溶液保持电中性,右侧OH-通过离子交换膜移向左侧,则离子交换膜应是阴离子交换膜,D错误。
6. [2022湖南岳阳模拟]双极膜是由一张阳膜和一张阴膜制成的复合膜,在直流电场作用下能将中间层中的H2O解离成H+和OH-。利用双极膜和维生素C的钠盐(C6H7O6Na)制备维生素C(C6H8O6),装置如图所示。已知维生素C具有弱酸性和还原性,下列说法正确的是 ( )A.X离子是H+,Ⅱ区出口处NaOH溶液的浓度减小B.M极的电势高于N极,电解一段时间后,阳极区附近溶液的pH变大C.将Ⅰ区的Na2SO4溶液替换成C6H7O6Na溶液,可以提高维生素C的产率D.当M极生成2.24 L(标准状况下)O2时,Ⅳ区溶液的质量增加8.8 g
6.D维生素C具有还原性,在Ⅰ区易被氧化,不能提高产率,C错误。M极生成标准状况下2.24 L(0.1 ml) O2时,电路中转移0.4 ml e-,进入Ⅳ区的Na+的质量是0.4 ml×23 g·ml-1=9.2 g,Ⅳ区生成H2的质量是0.2 ml×2 g·ml-1= 0.4 g,因此Ⅳ区溶液增加的质量是9.2 g-0.4 g=8.8 g,D正确。
1. [2022湖南六校联考](学术探索情境:锌碘单液流电池)中国科学院大连化物所的研究团队创新性地提出锌碘单液流电池的概念,该电池中电解液的利用率接近100%,其原理如图所示。下列说法正确的是 ( )A.放电时A电极的电极反应式为Zn2++2e-===ZnB.放电时电解质储罐中离子总浓度减小C.M为阴离子交换膜,N为阳离子交换膜D.充电时A极增重65 g,C区增加的离子数为2NA
3. [2022山西太原期末](学术探索情境:水系可逆Zn-CO2电池)中国将提高国家自主贡献力度,采取更加有力的政策和措施,二氧化碳排放力争于2030年前达到峰值,努力争取2060年前实现碳中和。我国科学家研发了一种水系可逆Zn-CO2电池,电池工作时,复合膜(由a、b膜复合而成)层间的H2O解离成H+和OH-,在外加电场作用下可通过相应的离子膜定向移动。当闭合K1时,Zn-CO2电池的工作原理如图所示。下列说法不正确的是 ( )A.闭合K1时,Pd电极电势高于Zn电极电势B.闭合K1时,Pd电极的电极反应式为CO2+2H+-2e-===HCOOHC.闭合K2时,OH-通过b膜向Pd电极方向移动D.Pd电极具有高效双催化性能,有利于CO2和HCOOH的相互转化
3.B 闭合K1时,构成原电池,则Zn电极为负极,Pd电极为正极,正极电势高于负极电势,A正确。闭合K1时,Pd电极为正极,正极得电子,结合题图可得,其电极反应式为CO2+2H++2e-===HCOOH,B错误。闭合K2时,构成电解池,Pd电极为阳极,阴离子移向阳极,则OH-通过b膜向Pd电极方向移动,C正确。Pd电极可以【注意】 复合膜层间的H2O电离出的H+移向正极,参与电极反应。实现CO2和HCOOH的相互转化,具有高效双催化性能,D正确。
1. [2022河南名校质检](原理创新:利用连续闭合的电化学-化学反应循环实现氮还原)某科研团队利用连续闭合的电化学-化学反应循环实现氮还原的原理示意图如图所示,其中Fe-TiO2作为氮还原的催化剂,则下列说法正确的是 ( )A.氢离子由A电极经过质子交换膜移向B电极B.电解液中POM2转化为POM1的过程为还原反应C.A电极的电势高于B电极D.该电池生成3 ml氧气时可还原标准状况下的氮气44.8 L
3. [2022福建福州考试](综合创新:电池装置+反应机理图示)盐酸羟胺(NH3OHCl)是一种常见的还原剂和显像剂,其化学性质类似于NH4Cl。工业上主要采用向两侧电极分别通入NO和H2,以盐酸为电解质来进行制备,其电池装置(图1)和含Fe的催化电极反应机理(图2)如下。不考虑溶液体积的变化,下列说法正确的是( )A.电池工作时,Pt电极为正极B.图2中,A为H+和e-,B为NH3OH+C.电池工作时,每消耗2.24 L NO(标准状况下),左室溶液质量增加3.3 gD.电池工作一段时间后,正、负极区溶液的pH均下降
3.C 电池工作时,Pt电极上H2失电子,为负极,电极反应式为H2-2e-===2H+,A项错误;根据题意可知,NH2OH具有弱碱性,可以和盐酸反应生成盐酸羟胺,离子方程式为NH2OH+H+===NH3OH+,故图2中A为H+,B为NH3OH+,B项错误;含铁的催化电极为正极,其电极反应式为NO+3e-+4H++Cl-===NH3OHCl,由电荷守恒知,当有1个NO被消耗时,需从负极迁移至正极3个H+,故左室增加的质量相当于“1个NO和3个H+”的质量,标准状况下,2.24 L NO的物质的量为0.1 ml,质量为3.0 g,则左室增加的质量为3.0 g+0.1 ml×3×1 g·ml-1=3.3 g,C项正确;由C项知,左室消耗0.1 ml NO时,反应0.1 ml HCl,再从右室迁移过来0.3 ml H+,故左室消耗0.1 ml H+,pH上升,负极的电极反应式为H2-2e-===2H+,当转移0.3 ml e-时,生成0.3 ml H+,再迁移到左室,故右室pH不变,D项错误。
5. [2022北京西城区期末](综合创新:实验+电化学)某小组同学欲用电解的方法获得Cu(OH)2,实验装置如图(电源装置略去)所示。(1)分别以NaOH溶液和NaCl溶液为电解质溶液制备Cu(OH)2。【资料】ⅰ.CuOH是黄色、易分解的难溶固体,CuCl是白色的难溶固体。ⅱ.氧化反应中,增大反应物浓度或减小生成物浓度,氧化反应越易发生。①实验Ⅰ和实验Ⅱ中铜电极作 (填“阳”或“阴”)极。 ②实验Ⅱ中石墨电极产生气体的电极反应式为 。③实验Ⅱ中部分沉淀由白色变为砖红色的反应的离子方程式是 。根据实验Ⅱ中的现象,甲同学认为电解质溶液中存在的Cl-有利于Cu被氧化,生成+1价铜的化合物,理由是 。 (2)为探究实验Ⅰ和实验Ⅱ中未生成Cu(OH)2的原因,继续实验。
【资料】碱式硫酸铜[xCu(OH)2·yCuSO4]难溶于水,可溶于酸和氨水。常温时碱式硫酸铜的溶解度比Cu(OH)2的大。①经检验,蓝绿色沉淀中含有碱式硫酸铜,检验方案是 。 ②该小组同学认为适当增大c(OH-)可以减少碱式硫酸铜的生成,理由是 。 (3)进一步改进方案,进行如下实验。实验Ⅳ中出现深蓝色说明电解生成了 (填离子符号)。经检验,实验Ⅴ中最终生成了Cu(OH)2。 (4)综合上述实验,电解法制备Cu(OH)2时要考虑的因素有 。
5.【参考答案】 (1)①阳 ②2H2O+2e-===H2↑+2OH- ③2CuCl+2OH-===Cu2O+2Cl-+H2O 阳极附近溶液中Cl-浓度增大,易与Cu+生成CuCl,减小溶液中Cu+的浓度,有利于Cu发生氧化反应(2)①取少量蓝绿色沉淀于试管中,滴加稀盐酸,沉淀全部溶解,得到蓝色溶液,向试管中滴加BaCl2溶液,产生白色沉淀 ②常温时碱式硫酸铜的溶解度比氢氧化铜的大(3)[Cu(NH3)4]2+(4)电解质溶液溶质的选择和溶液pH的控制【解题思路】 (1)①由题意可知,实验Ⅰ和实验Ⅱ中铜电极作电解池的阳极,铜失去电子发生氧化反应生成亚铜离子。②由题意可知,实验Ⅱ中石墨电极为电解池的阴极,水在阴极得到电子发生还原反应,电极反应式为2H2O+2e-===H2↑+2OH-。③由题意可知,实验Ⅱ中阴极产生的OH-向阳极定向移动,则沉淀由白色变为砖红色的反应为氯化亚铜与OH-反应生成氧化亚铜、氯离子和水的反应,离子方程式为2CuCl+2OH-===Cu2O+2Cl-+H2O。氯离子向阳极移动,阳极附近溶液中氯离子浓度增大,易与亚铜离子生成CuCl,减小溶液中生成的亚铜离子的浓度,由信息ⅱ可知,增大反应物浓度或减小生成物浓度有利于氧化反应发生,则电解质溶液中存在的氯离子有利于铜被氧化,生成+1价铜的化合物。
1.[2022福建福州三中质检]北京化工大学开发的一种流动电池的原理如图所示,其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。下列有关说法不正确的是 ( )A.调节电解质溶液的方法是补充CuSO4B.a极为负极,b极为正极C.电池总反应为Cu+PbO2+2H2SO4===CuSO4+PbSO4+2H2OD.该电池工作时,PbO2极附近溶液的pH增大
2. [2022广东佛山质检]一种新型钠-空气电池装置如图所示。该电池利用多孔石墨电极形成空气通道,放电时生成的NaOx填充在空位中,当空位填满后,放电终止。下列说法正确的是 ( )A.a极为电池正极B.b极的电极反应为xO2+2e-+2Na+===2NaOxC.电子移动方向:b极→导线→a极D.理论上a极每减重46 g,b极消耗约22.4 L氧气
3. [2022上海浦东新区一模]一定条件下,钢铁腐蚀与溶液pH的关系如下。下列说法正确的是 ( )A.碱性越强,钢铁腐蚀越困难B.中性环境中,钢铁较难腐蚀C.pH>14时,钢铁腐蚀的正极反应为O2+4H++4e-===2H2OD.自然界中,钢铁腐蚀的产物只有Fe2O3
4. [2022辽宁沈阳重点高中考试]一种微生物燃料电池的结构示意图如下,下列关于该电池的叙述正确的是 ( )A.电池工作时,电子由a流向bB.微生物所在电极区放电时发生还原反应C.放电过程中,H+从正极区移向负极区D.正极反应式为MnO2+4H++2e-===Mn2++2H2O
5.[2022陕西宝鸡一检]光电池在光照条件下可产生电压,如图所示装置可实现光能的充分利用。双极膜复合层间的H2O能解离为H+和OH-,且双极膜能实现H+和OH-的定向通过。下列说法不合理的是 ( )A.该装置工作时涉及光能、化学能及电能的转化B.光照过程中阳极区溶液中的n(OH-)基本不变C.再生池中的反应为2V2++2H+ 2V3++H2 ↑D.阳极生成1 ml O2时,理论上双极膜共解离出的离子数为4NA
5.D【原理分析】 由图上电子的移动方向可知右侧为电解池的阳极,电极反应式为4OH--4e-===2H2O+O2↑,左侧为电解池的阴极,电极反应式为 2V3++2e-===2V2+,双极膜将水解离为H+和 OH-,H+移向阴极,OH-移向阳极。放电后的溶液进入再生池中,在催化剂作用下发生反应放出氢气,反应方程式为2V2++2H+ 2V3++H2↑。由图可知,光电池利用光照将光能转化为电能,电解池将电能转化为化学能储存于化合物中。由图可知,该装置工作时涉及光能、化学能及电能的转化,A项正确;结合上述分析及溶液呈电中性知,阳极区溶液中的n(OH-)基本不变,B项正确;根据以上分析知,C项正确;根据阳极的电极反应式4OH--4e===2H2O+O2↑知, 当阳极生成1 ml O2时,阳极消耗4 ml OH-,则双极膜共解离出4 ml OH-和4 ml H+,故解离出的离子数为8NA,D项错误。
6. [2022山东济南检测]采用电渗析法可以从含NH4H2PO4和(NH4)2HPO4的废水中回收NH3·H2O和H3PO4,电解装置如图所示。下列说法正确的是 ( )A.X电极应连接电源的正极B.M口处回收产生的浓氨C.隔膜ab为阳离子交换膜,隔膜cd为阴离子交换膜D.电解一段时间后,产生的NH3·H2O和H3PO4的物质的量相等
7.[2022安徽马鞍山一测]可利用铜配合物1,10-phenanthrline-Cu作催化剂电催化还原CO2制备碳基燃料(包括CO、烷烃和酸等),其装置原理如图所示。下列说法正确的是 ( )A.石墨烯为阴极,电极反应式为CO2+2H2O+2e-===HCOOH+2OH-B.该装置工作时,H+穿过质子交换膜从右向左移动C.每转移2 ml电子,阴极室电解质溶液质量增加46 gD.该装置工作一段时间后,阳极室电解质溶液的pH不变
7.C 石墨烯上CO2转化为HCOOH,发生还原反应,石墨烯为阴极,电解质溶液呈酸性,则阴极反应为CO2+ 2H++2e-=== HCOOH,A项错误;该装置为电解池,工作时H+穿过质子交换膜从阳极向阴极移动,即从左向右移动,B项错误;根据阴极反应知,每转移2 ml电子,阴极室电解质溶液中增加1 ml CO2和2 ml H+,质量为46 g,C项正确;阳极的电极反应式为2H2O-4e-===4H++O2↑,生成的H+向阴极移动,同时消耗溶剂水,故该装置工作一段时间后,阳极室电解质溶液的pH变小,D项错误。
8. [2022福建福州质检]水系锌离子电池是一种新型二次电池,工作原理如图。该电池以粉末多孔锌电极(锌粉、活性炭及粘结剂等)和V2O5为电极,三氟甲磺酸锌[Zn(CF3SO3)2]为电解液,总反应为xZn+ V2O5=== ZnxV2O5(s)。下列叙述错误的是 ( )A.充电时,粉末多孔锌电极连接电源的负极B.放电时,V2O5电极上发生的反应为V2O5+2e-+xZn2+===ZnxV2O5C.充电时,Zn2+通过阳膜由右池移向左池D.理论上,充放电过程中电解质溶液的质量均未改变
8.B 由电池总反应可知,放电时,粉末多孔锌电极是负极,则充电时,粉末多孔锌电极为阴极,连接电源的负极,A项正确;放电时,V2O5电极上发生反应V2O5+2xe-+xZn2+===ZnxV2O5,B项错误;充电时,左池是阴极室,Zn2+通过阳膜由右池移向左池,C项正确;由总反应可知,电解液不参与电极反应,故理论上充放电过程中电解质溶液的质量均未改变,D项正确。
9. [2022山东济南模拟]在直流电源作用下,双极膜中间层中的H2O解离为H+和OH-,利用双极膜电解池产生的强氧化性羟基自由基(·OH)处理含苯酚废水和含SO2的烟气的工作原理如图所示。下列说法错误的是 ( )A.电势:N电极>M电极B.阴极电极反应式为O2+2e-+2H+===2·OHC.每处理9.4 g苯酚,理论上有2.8 ml H+透过膜aD.若·OH只与苯酚和SO2反应,则参加反应的苯酚和SO2物质的量之比为1∶14
11. [2022北京海淀区期末]传统方法制备H2O2会产生大量副产物,研究者通过更环保的电解法,使用空气和水制备H2O2。电解制备H2O2,装置示意图如图所示。(1)a极的电极反应式为 。 (2)通过管道将b极产生的气体送至a极,目的是 。 (3)pH过高时H2O2会分解。但电解一段时间后,a极附近溶液的pH基本不变,原因是 。 (4)测定生成的H2O2浓度。取x mL H2O2溶液,用a ml·L-1 Ce(SO4)2溶液滴定H2O2,完全反应转化为Ce2(SO4)3时,消耗b mL Ce(SO4)2溶液。则H2O2溶液的浓度为 ml·L-1。
12. [2022广东六校联考]硫酸铅可用于制造蓄电池,如图是研究小组应用铅蓄电池模拟工业生产的电化学装置,a、b、c、d四电极均为惰性电极,甲装置电解质溶液为CuSO4溶液,丙装置电解质溶液为KCl溶液,忽略气体溶解,当电路中通过0.4 ml电子时,丙装置阳极室溶液质量减少 g,向甲所得溶液中加入Cu2(OH)2CO3能使溶液复原,则b电极的电极反应式为 。
相关课件
这是一份2023版高考化学一轮复习新题精练第十一章化学实验课件,共60页。PPT课件主要包含了必备知识新题精练,关键能力强化提升,高频易错高效快攻,考点3物质的制备,题组2无机物的制备,题组3有机物的制备,考点4定量实验,题组定量实验,题组实验探究与设计,疑难点专练等内容,欢迎下载使用。
这是一份2023版高考化学一轮复习新题精练第七章化学反应速率与化学平衡课件,共60页。PPT课件主要包含了必备知识新题精练,关键能力强化提升,高频易错高效快攻,考点2化学平衡,疑难点专练,情境创新专练,提升素养拓展思维,题型专练创新集训,全章综合训练等内容,欢迎下载使用。
这是一份2023版高考化学一轮复习新题精练第六章化学反应的热效应课件,共53页。PPT课件主要包含了必备知识新题精练,关键能力强化提升,高频易错高效快攻,题组1热化学方程式,情境创新专练,提升素养拓展思维,题型专练创新集训,全章综合训练等内容,欢迎下载使用。









