


苏教版高考化学一轮复习4非金属及其化合物第11讲氯溴碘及其化合物课件
展开【课标要求】 1.掌握氯单质及其重要化合物的主要性质及应用。2.了解氯单质及其重要化合物对环境质量的影响。3.掌握氯气的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。4.了解卤族元素的性质递变规律及与化工生产相结合的资源综合利用。
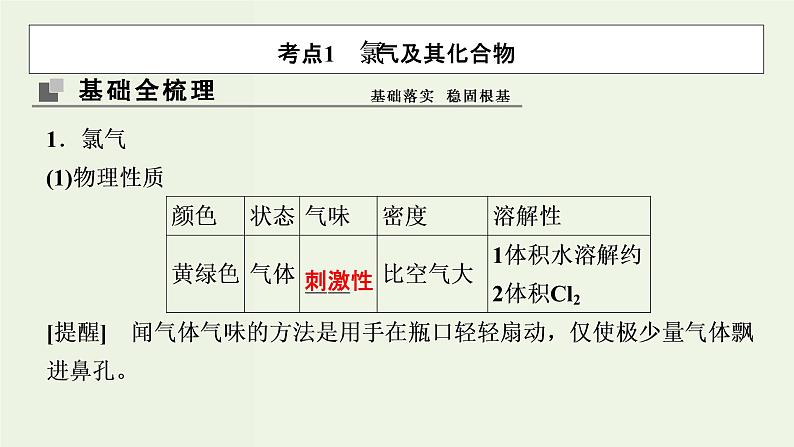
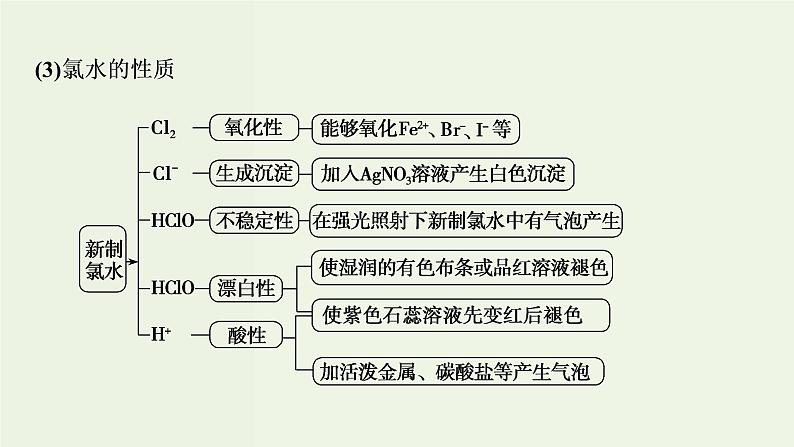
考点1 氯气及其化合物
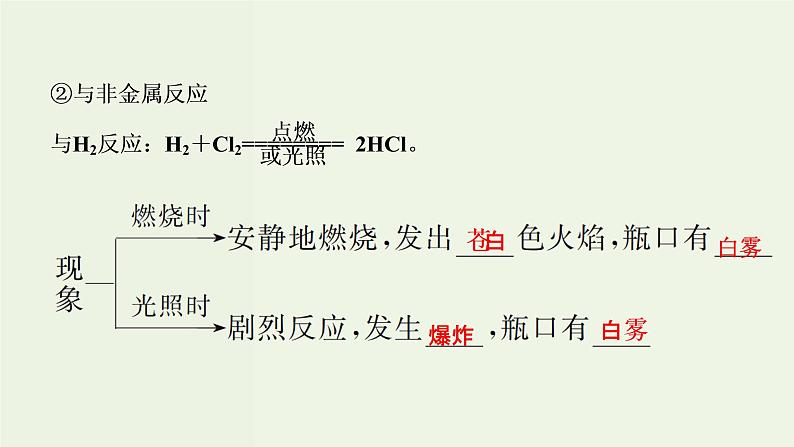
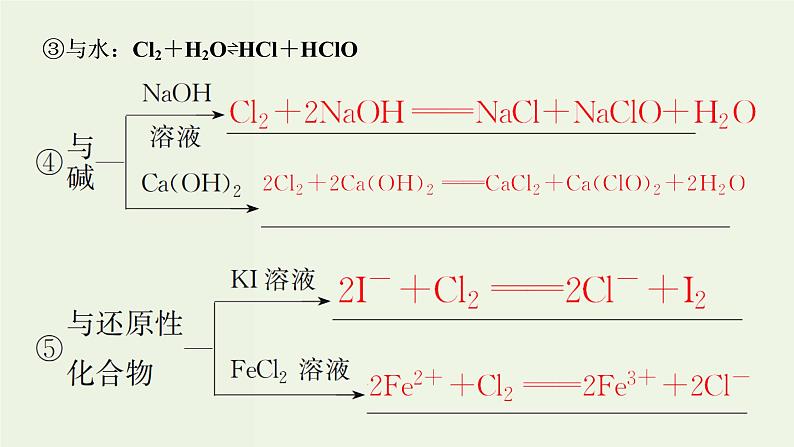
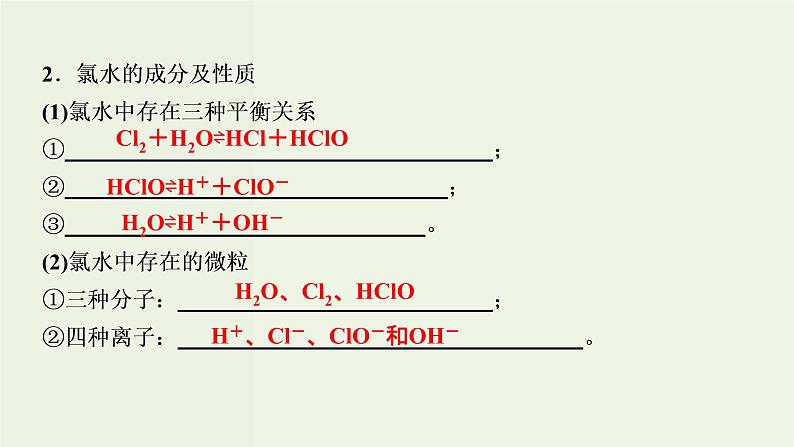
Cl2+H2O⇌HCl+HClO
HClO⇌H++ClO-
H2O⇌H++OH-
H2O、Cl2、HClO
H+、Cl-、ClO-和OH-
H2O、H+、Cl-、OH-
ClO-+Cl-+2H+===Cl2↑+H2O
Ca(ClO)2和CaCl2
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
(1)过量的铁粉在少量氯气中加热,充分反应后产物为FeCl2。( )(2)氯气溶于水得氯水,溶液呈酸性且可以导电,所以氯气是电解质。( )(3)新制取的漂白粉是混合物。( )(4)氯气可以使湿润的有色布条褪色,但是实际起漂白作用的物质是次氯酸,而不是氯气。( )(5)Cl2具有很强的氧化性,在化学反应中只能作氧化剂。( )(6)标准状况下,11.2 L Cl2与水充分反应转移电子数为0.5NA。 ( )(7)“84”消毒液的消毒原理与H2O2的相同,都是利用强氧化性。( )
在空气中长时间放置的漂白粉,最终得到的主要固体物质是什么?用方程式表示漂白粉在空气中久置变质的过程。________________________________________________________________________________________________________________________
题组一 氯气的性质及应用1.(双选)下列有关氯及其化合物叙述错误的是( )A.红热的铜丝在氯气中剧烈燃烧,生成棕黄色的烟B.大量氯气泄漏时,应用浸有弱碱性溶液的毛巾捂住口鼻向低处跑C.AlCl3、FeCl2、FeCl3均可通过化合反应制得D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
2.根据下列装置图回答问题(1)A、B通入Cl2后,观察到的现象是________________________________________________________________________________________,根据现象可得出的结论是_________________________________________________________________________________________________。
(2)集气瓶B中发生反应的离子方程式是_________________________________________________________________________________________。(3)F装置的作用是____________________________________________。(4)实验开始后,观察装置C中的现象是________________________________________________________________________________________。(5)装置E中发生反应的离子方程式是___________________________________________________________________________________________。(6)通入Cl2时装置D中发生反应的离子方程式是__________________________________________________________________________________。
解析:次氯酸钠具有强氧化性,能与福尔马林中的甲醛发生化学反应,A错误;NaClO在溶液中水解生成HClO,从而具有漂白性和强氧化性,B错误;根据电离平衡常数分析,反应应该生成次氯酸和碳酸氢根离子,D错误。
考点2 氯气的实验室制法
强碱溶液(如NaOH溶液)
3.验满方法(1)将湿润的淀粉碘化钾试纸靠近盛Cl2的集气瓶口,观察到试纸立即变 __________,则证明已集满。排饱和食盐水(2)将湿润的蓝色石蕊试纸靠近盛Cl2的集气瓶口,观察到试纸 __________________,则证明已集满。(3)根据集气瓶中气体的颜色判断是否集满。
(1)含4 ml HCl的浓盐酸与足量MnO2反应,可制备22.4 L Cl2。( )(2)用饱和NaHCO3溶液除去Cl2中混有的HCl。( )(3)用浓硫酸或碱石灰干燥Cl2。( )(4)可用排饱和食盐水法收集Cl2。( )(5)常用饱和石灰水吸收尾气中的Cl2。( )(6)用干燥的淀粉碘化钾试纸检验Cl2是否收集满。( )
答案:(1)向上排空气法收集氯气(2)安全瓶作用,防止D中的液体倒吸入B中(3)吸收尾气,防止氯气扩散到空气中污染环境
解析:A.高锰酸钾具有强氧化性,浓盐酸与高锰酸钾在常温下发生氧化还原反应可生成氯气,能用于制取氯气,A正确;B.氯气和氯化氢气体都能与氢氧化钠溶液反应,应用饱和食盐水除去氯气中的氯化氢,B错误;C.氯气与饱和食盐水不反应,应用氢氧化钠溶液进行尾气处理,C错误;D.氯水中含有次氯酸,次氯酸具有漂白性,可漂白pH试纸,不能用pH试纸测定氯水的pH,D错误。
解析:A.实验室用二氧化锰和浓盐酸反应制备氯气,二氧化锰和浓盐酸反应需要加热,甲装置没有加热装置,A错误;B.Cl2和HCl均与饱和碳酸氢钠溶液反应,不能除杂,氯气中混有的HCl气体可以用饱和食盐水除去,B错误;C.氯气的密度比空气大,收集时应采用向上排空气法,图中为向下排空气法,C错误;D.氯气有毒,不能直接排放,氯气能与氢氧化钠反应,图中装置可吸收尾气,D正确。
3.下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )A.a-b-c-d-e-f-g-hB.a-e-d-c-b-h-i-gC.a-d-e-c-b-h-i-gD.a-c-b-d-e-h-i-f
(1)装置④中的X试剂为________________________________________。(2)装置③中发生反应的化学方程式为________________________________________________________________________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减小副反应发生的方法是______________________________________________________________________________________________。
考点3 卤素的性质及X-的检验
NaX+NaXO+H2O
溴水是中学化学中常用的试剂,请思考总结中学化学实验中有哪些使溴水褪色的情况?_________________________________________________________________________________________________________________________________________________________________________________________。
题组一 卤素性质的递变规律1.下列有关卤素的说法错误的是( )A.从HF、HCl、HBr、HI酸性递增的事实,可推出F、Cl、Br、I的非金属性递增的规律B.HF、HCl、HBr、HI的热稳定性依次减弱,还原性依次增强C.淀粉碘化钾溶液在空气中变蓝,4I-+O2+2H2O===2I2+4OH-D.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度
解析:元素的非金属性强弱与其对应的氢化物溶液的酸性强弱无关,可根据其最高价氧化物对应的水化物的酸性强弱进行比较,A错误;I2在KI溶液中存在平衡I2+I-⇌I-3,可使其溶解度增大,D正确。
下列有关说法正确的是( )A.a处变蓝、b处变棕红,说明非金属性:Cl>Br>IB.c处先变红后褪色,说明Cl2与H2O反应生成HClC.d处立即褪色,不能说明Cl2与H2O反应生成HClOD.e处变红,说明Cl2与Fe2+反应生成Fe3+
4.鉴别NaCl、NaBr、NaI可以选用的试剂是( )①碘水、淀粉溶液 ②氯水、CCl4 ③溴水、苯 ④稀硝酸、AgNO3溶液 ⑤氯水、苯 ⑥FeCl3溶液、CCl4A.①②④ B.②③⑥ C.②④⑤ D.④⑤⑥
解析:①NaCl、NaBr、NaI中加碘水和淀粉溶液均变蓝色;②氯水加入NaBr、NaI中后,再加CCl4萃取,下层分别为橙红色和紫红色,加入NaCl中不发生反应,可以鉴别;③溴水与NaCl、NaBr不反应,与NaI反应生成I2,用苯萃取后,前两种上层均为橙红色,无法鉴别;④NaCl、NaBr、NaI与AgNO3溶液反应分别生成AgCl、AgBr、AgI沉淀,且均不溶于稀HNO3,沉淀颜色依次为白色、淡黄色、黄色;⑤与②的原理相似,只是有色层在上层;⑥FeCl3溶液只能氧化I-生成I2,不能鉴别。
题组三 卤素单质氧化性强弱的实验探究5.为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检查)。
实验过程:Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。Ⅳ.……(1)A中产生黄绿色气体,其电子式是___________________________。(2)验证氯气的氧化性强于碘的实验现象是_________________________________________________。
(3)B中溶液发生反应的离子方程式是_________________________________________________________________________________________。(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是__________________________________________________________________________________________________________________________。(5)过程Ⅲ实验的目的是______________________________________________________________________________________________________。(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下____________,得电子能力逐渐减弱。
提取卤素单质的化工流程
解析:Na2SO3+Br2+H2O===Na2SO4+2HBr,A正确;步骤Ⅲ利用氯的非金属性比溴的强,利用置换反应制取Br2,B正确;反应Ⅰ和反应Ⅲ均使用到Cl2,故制取1 ml Br2消耗2 ml氯气,但未标明氯气所处的温度和压强,C错误;从浓溴水中提取溴,可利用有机溶剂(如苯)萃取溴,然后分液得到溴的有机溶液,再经蒸馏可得纯净的溴,D正确。
4.海水开发利用的部分过程如图所示。下列说法错误的是( )A.向苦卤中通入Cl2是为了提取溴B.粗盐可采用除杂和重结晶等过程提纯C.工业生产中常选用NaOH作为沉淀剂D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
1.下列说法不正确的是( )A.液氯可以储存在钢瓶中(2019·高考浙江卷,8A)B.用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色(2019·高考浙江卷,11A)C.电解饱和食盐水可制取氯气 (2018·高考浙江卷,8B)D.碘酒可用于皮肤外用消毒 (2019·高考全国卷Ⅲ,7D)
解析:氯气可溶于水,在常温时,1体积水大约能溶解2体积氯气,因而20 mL水大约能溶解40 mL氯气,气体大约剩余40 mL未溶解,B项错误。
2.下列说法不正确的是 ( )A.漂白粉可用于生活用水的消毒(2018·高考全国卷Ⅱ,7B)B.石蕊溶液滴入氯水中,溶液变红,随后迅速褪色,不涉及氧化还原反应(2018·高考北京卷,9B)C.氯水具有较强的氧化性,可用于漂白纸张、织物等 (2018·高考海南卷,5D)D.清洗碘升华实验所用试管,先用酒精清洗,再用水清洗(2017·高考全国卷Ⅲ,9B)
解析:B项,红色褪去是HClO表现强氧化性,错误;D项,碘易溶于酒精,可用酒精清洗碘,又由于酒精与水互溶,再用水清洗即可洗净,正确。
3.(2018·高考江苏卷)下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( )A.用装置甲灼烧碎海带B.用装置乙过滤海带灰的浸泡液C.用装置丙制备用于氧化浸泡液中I-的Cl2D.用装置丁吸收氧化浸泡液中I-后的Cl2尾气
高考化学一轮复习第4章非金属及其化合物第2节富集在海水中的元素__氯课件: 这是一份高考化学一轮复习第4章非金属及其化合物第2节富集在海水中的元素__氯课件,共60页。PPT课件主要包含了必备知识·关键能力,+2HCl,热点聚焦·考能提升,真题验收·新题预测等内容,欢迎下载使用。
浙江专用高考化学一轮复习专题4非金属及其化合物第一单元氯溴碘及其化合物课件: 这是一份浙江专用高考化学一轮复习专题4非金属及其化合物第一单元氯溴碘及其化合物课件,共60页。PPT课件主要包含了刺激性,易挥发,易升华,淡黄色,Br-等内容,欢迎下载使用。
2022高考化学一轮复习第4章非金属及其化合物第2讲氯及其重要化合物课件: 这是一份2022高考化学一轮复习第4章非金属及其化合物第2讲氯及其重要化合物课件,共54页。PPT课件主要包含了知识点1,刺激性,知识点2,知识点3等内容,欢迎下载使用。












