



苏教版高考化学一轮复习6化学反应与能量变化第19讲电解池金属的电化学腐蚀与防护课件
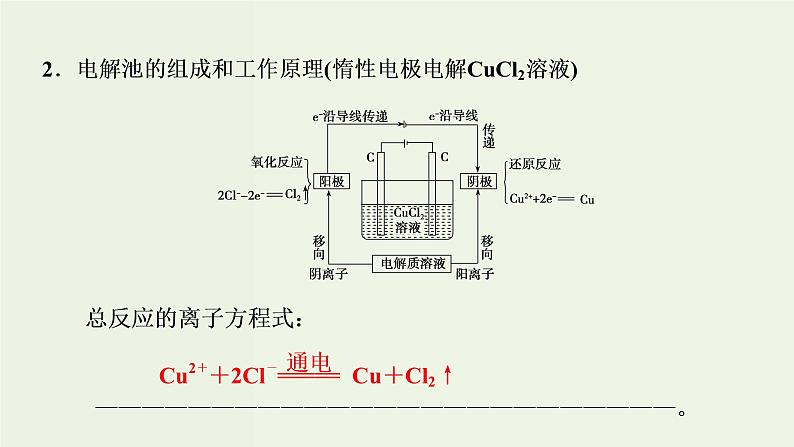
展开【课标要求】 1.理解电解池的构成、工作原理及应用,能书写电极反应和总反应方程式。2.了解金属发生电化学腐蚀的原因、金属腐蚀的危害、防止金属腐蚀的措施。
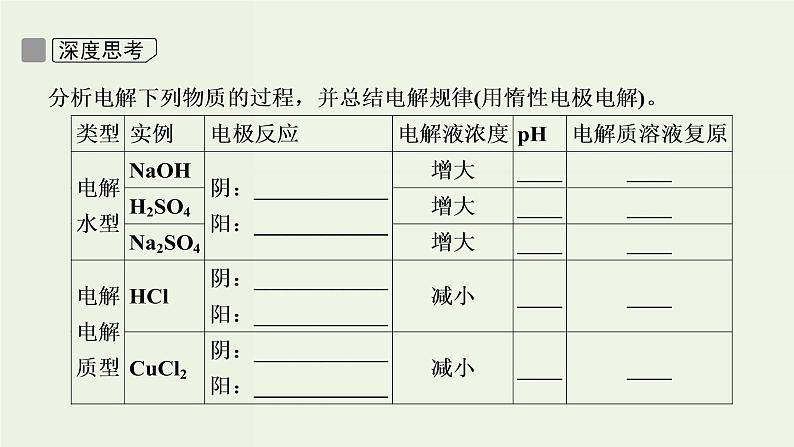
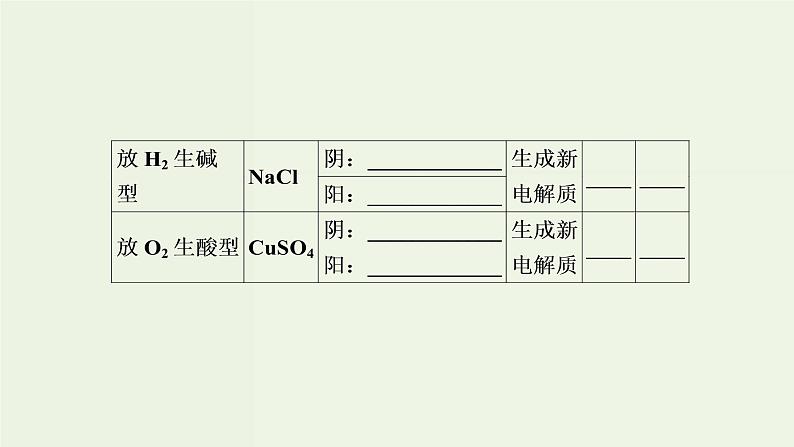
(1)电解质溶液的导电过程就是电解质溶液被电解的过程。( )(2)某些不能自发进行的氧化还原反应,通过电解可以实现。( )(3)直流电源跟电解池连接后,电子从电源负极流向电解池阳极。( )(4)电解稀硫酸制H2、O2时,可用不活泼的铜作阳极。( )(5)电解CuCl2溶液,阴极逸出的气体能够使湿润的淀粉碘化钾试纸变蓝色。( )(6)电解盐酸、硫酸等溶液,H+放电,溶液的pH均增大。( )
题组一 电解原理1.以石墨为电极,电解KI溶液(含有少量的酚酞和淀粉)。下列说法错误的是( )A.阴极附近溶液呈红色B.阴极逸出气体C.阳极附近溶液呈蓝色D.溶液的pH变小
题组二 电极反应式、电解方程式的书写3.(1)用惰性电极电解MgCl2溶液阳极反应式:________________________________________________;阴极反应式:________________________________________________;总反应离子方程式:__________________________________________。(2)用铁做电极电解NaCl溶液阳极反应式:________________________________________________;阴极反应式:________________________________________________;总反应化学方程式:__________________________________________。
(3)用Al做电极电解NaOH溶液阳极反应式:__________________________________________________;阴极反应式:__________________________________________________;总反应离子方程式:____________________________________________。(4)用Al做阳极,电解H2SO4溶液,铝材表面形成氧化膜阳极反应式:_________________________________________________;阴极反应式:_________________________________________________;总反应离子方程式:____________________________________________。
(1)写出电解时阴极的电极反应式:_____________________________________________________________________________________________。(2)电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成____________________________________________________________________________________________________________________________。
5.某水溶液中含有等物质的量浓度的Cu(NO3)2和NaCl,以惰性电极对该溶液进行电解,分阶段写出电解反应的化学方程式。______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
从原理和事实出发,对阴、阳极上的放电纠偏
阳极发生失电子的氧化反应,本质是放电离子还原性的体现,某些处于较低价态阳离子具有较强的还原性,可以在阳极放电发生氧化反应。[典例2] 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料。回答下列问题:PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为_________________________,阴极上观察到的现象是_________________________________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为_____________________________________________________________,这样做的主要缺点是_______________________________________。
当条件合适的情况下,电中性的分子也有可能参与电极反应。
考点2 电解原理在工业生产中的应用
2Cl--2e-===Cl2↑
2H2O+2e-===H2↑+2OH-
Ag-e-===Ag+
Ag++e-===Ag
Zn-2e-===Zn2+
Fe-2e-===Fe2+
Ni-2e-===Ni2+
Cu-2e-===Cu2+
Cu2++2e-===Cu
2Na++2e-===2Na
6O2--12e-===3O2↑
4Al3++12e-===4Al
2.今有下列两种装置:(1)请分析两装置中各电极的质量变化?(2)请分析两装置中电解质溶液浓度的变化?___________________________________________________________________________________________________________________________________________________________________________________________。
题组一 应用电解原理制备新物质1.如图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛。下列说法正确的是( )
2.氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。如图是离子交换膜法电解饱和食盐水的示意图,图中的离子交换膜只允许阳离子通过。
4.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。
离子交换膜在电化学中的运用
1.离子交换膜的功能使离子选择性定向迁移(目的是平衡整个溶液的离子浓度或电荷)。2.离子交换膜的类型根据透过的微粒,离子交换膜可以分为多种,在高考试题中主要出现阳离子交换膜、阴离子交换膜和质子交换膜三种。阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,阴离子交换膜只允许阴离子通过,质子交换膜只允许质子(H+)通过。可见离子交换膜的功能在于选择性地通过某些离子和阻止某些离子来隔离某些物质。
3.离子交换膜在电化学中的运用(1)构成双液原电池,闭合电路,提高放电寿命与效率单液原电池由于活性电极材料与电解质溶液直接接触,无法避免放电的同时不发生化学腐蚀,导致能量转化效率低、放电不稳定、使用寿命短等问题。将单液原电池转换为双液原电池可减弱上述问题。解决此问题可使用盐桥或离子交换膜形成负极室和正极室。相对于盐桥,离子交换膜表面积较大,有利于增大离子的定向移动速率,减小电阻,放电效率提高,使用寿命增长。
(2)制备提纯物质:隔离微粒,提高物质的产率与纯度膜电解法是制备物质的重要方法,它将电解和膜分离相结合,将制备、分离和浓缩相结合。即“在通电条件下发生电解化学反应时,生成的产物能及时地从反应体系中通过离子交换膜分离出来,使反应向生成物的方向进行,从而提高反应效率。”其中最重要的膜电解运用于氯碱工业以及废水处理等。(3)多室电渗析:交替运用阴膜阳膜,完成物质淡化与浓缩电渗析是将阴膜与阳膜交替排列在电极之间,在直流电场作用下,以电位差为动力,离子透过选择性离子交换膜而迁移,从而使电解质离子自溶液中部分分离出来,实现溶液的浓缩与淡化,复分解反应及电解氧化还原等效能,达到提纯精制的目的。
[考能突破练]1.(双选)已知:电流效率=电路中通过的电子数与消耗负极失去电子总数之比。现有两个电池Ⅰ、Ⅱ,装置如图所示。下列说法正确的是( )A.Ⅰ和Ⅱ的电池反应相同B.能量转化形式不同C.Ⅰ的电流效率低于Ⅱ的电流效率D.5 min后,Ⅰ、Ⅱ中都只含1种溶质
2.室温时,在FeCl3酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+,组成的原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
3.现有离子交换膜、石墨电极和如图所示的电解槽,电解KI的淀粉溶液制取KOH,一段时间后Ⅲ区附近变蓝色,下列叙述中错误的是( )A.KOH、H2均在Ⅰ区产生B.图中A为阴离子交换膜C.Ⅲ区的电极连接电源的正极D.阴极反应式为2H2O+2e-===H2↑+2OH-
考点3 金属的腐蚀与防护
2H++2e-===H2↑
2H2O+O2+4e-===4OH-
3.金属的防护(1)牺牲阳极的阴极保护法利用 原理。(2)外加电流的阴极保护法利用 原理。(3)改变金属内部结构→如制成不锈钢。(4)加保护层→如电镀、喷漆、覆膜等。
(1)纯银器表面变黑和钢铁表面生锈腐蚀原理一样。( )(2)Al、Fe、Cu在潮湿的空气中腐蚀均生成氧化物。( )(3)钢铁发生电化学腐蚀时,负极铁失去电子生成Fe3+。( )(4)在金属表面覆盖保护层,若保护层破损后,就完全失去了对金属的保护作用。( )(5)若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀。( )(6)铁表面镀锌可增强其抗腐蚀性。( )
A.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-===2H2OB.在pH<4溶液中,碳钢主要发生析氧腐蚀C.在pH>6溶液中,碳钢主要发生吸氧腐蚀D.在煮沸除氧气的碱性溶液中,碳钢腐蚀速率会减缓
1.判断金属腐蚀快慢的规律(1)对同一电解质溶液来说,腐蚀速率的快慢:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀。(2)对同一金属来说,在不同溶液中腐蚀速率的快慢:强电解质溶液中>弱电解质溶液中>非电解质溶液中。(3)活动性不同的两种金属,活动性差别越大,腐蚀速率越快。(4)对同一种电解质溶液来说,电解质溶液浓度越大,金属腐蚀越快。2.两种保护方法的比较外加电流的阴极保护法保护效果大于牺牲阳极的阴极保护法。
3.(2017·高考全国卷Ⅰ)支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )A.通入保护电流使钢管桩表面腐蚀电流接近于零B.通电后外电路电子被强制从高硅铸铁流向钢管桩C.高硅铸铁的作用是作为损耗阳极材料和传递电流D.通入的保护电流应该根据环境条件变化进行调整
解析:钢管桩接电源的负极,高硅铸铁接电源的正极,通电后,外电路中的电子从高硅铸铁(阳极)流向正极,从负极流向钢管桩(阴极),A、B正确;C项,题给信息高硅铸铁为“惰性辅助阳极”不损耗,C错误;D正确。
(1)写出电解时阴极的电极反应式____________________________________________________________________________________________。(2)电解过程中通过阳离子交换膜的离子主要为______,其迁移方向是___________________________________________________________。(3)与“电解法”相比,“KClO3氧化法”的主要不足之处有______________________________________________________________________________________________________________(写出一点)。
第18讲 电解池 金属的电化学腐蚀与防护 2024年高考化学一轮复习课件: 这是一份第18讲 电解池 金属的电化学腐蚀与防护 2024年高考化学一轮复习课件,共43页。PPT课件主要包含了知识回顾,复习目标,必备知识识记理解,考点一电解原理,阳极的判断方法,知识锦囊,阳氧阴还,秒判正误,关键能力讲练提升,名师点睛等内容,欢迎下载使用。
2022年高考化学一轮复习课件 第6章 第31讲 电解池 金属的电化学腐蚀与防护 (含解析): 这是一份2022年高考化学一轮复习课件 第6章 第31讲 电解池 金属的电化学腐蚀与防护 (含解析),共60页。PPT课件主要包含了复习目标,考点一电解的原理,真题演练明确考向,课时精练巩固提高,内容索引,知识梳理·夯基础,化学能,还原反应,氧化反应,Cl--2e-等内容,欢迎下载使用。
苏教版高考化学一轮复习6化学反应与能量变化第18讲原电池化学电源课件: 这是一份苏教版高考化学一轮复习6化学反应与能量变化第18讲原电池化学电源课件,共60页。PPT课件主要包含了氧化反应,还原反应,考点2化学电源,KOH,Ag2O等内容,欢迎下载使用。












