





苏教版高考化学一轮复习7化学反应速率与化学平衡第21讲化学反应进行的方向和限度课件
展开【课标要求】 1.了解化学平衡常数的含义并能利用化学平衡常数进行相关计算。2.能正确计算化学反应的转化率(α)。3.了解化学反应的方向与化学反应的焓变与熵变的关系。
考点1 化学平衡常数及其应用
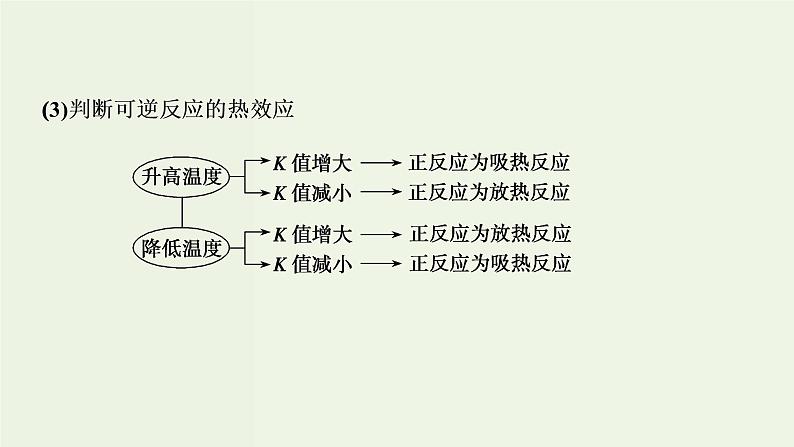
3.意义及影响因素(1)K值越大,反应物的转化率越大,正反应进行的程度越大。(2)K只受______影响,与反应物或生成物的浓度变化无关。(3)化学平衡常数是指某一具体反应的平衡常数。
答案:(1)正反应(2)850 ℃ 向正反应方向进行中
考点2 有关化学平衡常数的计算
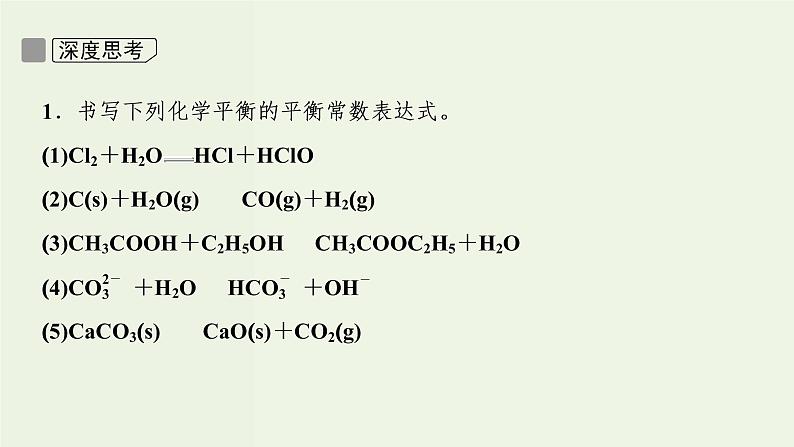
2.明确三个量的关系(1)三个量:即起始量、变化量、平衡量(2)关系①对于同一反应物,起始量-变化量=平衡量。②对于同一生成物,起始量+变化量=平衡量。③各转化量之比等于各反应物的化学计量数之比。
答案:(1)25% (2)增大 (3)6 (4)41%
借用题链,破解平衡常数的命题角度
[答案] 0.07 MPa-1
平衡常数、质量作用定律
化学反应原理在物质制备中的调控作用
1.化学反应方向的判定(1)自发反应在一定条件下无须外界帮助就能自发进行的反应称为自发反应。
2.化工生产适宜条件选择的一般原则(1)从化学反应速率分析,既不能过快,又不能太慢。(2)从化学平衡移动分析,既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性。(3)从原料的利用率分析,增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本。(4)从实际生产能力分析,如设备承受高温、高压能力等。(5)注意催化剂的活性对温度的限制。
3.平衡类问题需综合考虑的几个方面(1)原料的来源、除杂,尤其考虑杂质对平衡的影响。(2)原料的循环利用。(3)产物的污染处理。(4)产物的酸碱性对反应的影响。(5)气体产物的压强对平衡造成的影响。(6)改变外界条件对多平衡体系的影响。
答案:①②反应均为放热量大的反应 ①
(4)研究表明某些过渡金属催化剂可以加速氨气的分解,某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解的初始速率(单位:mml·min-1)与催化剂的对应关系如表所示。在不同催化剂的催化作用下,氨气分解反应中的活化能最大的催化剂是________(填化学式)。
③A.使用催化剂对正、逆反应速率的影响相同,平衡不发生移动,因此不能提高反应物的转化率,A错误;B.循环使用N2、H2,可使更多的反应物变为生成物,因此能够提高NH3的产率,B正确;C.该反应的正反应是放热反应,温度降低平衡正向移动有利于反应向正方向进行,温度控制在500 ℃左右,是因为在该温度下催化剂的活性最大,反应速率较快,C错误;D.反应物是气体,该反应的正反应是气体体积减小的反应,从理论上讲增大压强有利于加快反应速率,提高物质平衡转化率,但压强越高,需要的动力越大,对设备的材料承受的压力要求也越高,所以不是压强越大就越好,D错误。
答案:(1)小于 (2)N2(g)+3H2(g)⇌2NH3(l) ΔH=-132 kJ·ml-1 (3)①0.112 5 ②C ③B④6.25 (4)Fe
(4)物质发生反应时的活化能越大,反应进行的化学速率就越小。根据表格数据可知:以Fe作催化剂时反应速率最小,则氨分解反应的活化能最大,故在不同催化剂的催化作用下,氨气分解反应中的活化能最大的催化剂是Fe。
答案:(1)大于 (2)C
人教版高考化学一轮复习第7章化学反应速率和化学平衡第1讲化学反应速率课件: 这是一份人教版高考化学一轮复习第7章化学反应速率和化学平衡第1讲化学反应速率课件
高考化学一轮复习第7章化学反应速率和化学平衡第3节化学平衡常数化学反应进行的方向课件: 这是一份高考化学一轮复习第7章化学反应速率和化学平衡第3节化学平衡常数化学反应进行的方向课件,共60页。PPT课件主要包含了必备知识·关键能力,化学平衡,浓度幂之积,热点聚焦·考能提升,真题验收·新题预测等内容,欢迎下载使用。
苏教版高考化学一轮复习7化学反应速率与化学平衡第22讲化学平衡的移动课件: 这是一份苏教版高考化学一轮复习7化学反应速率与化学平衡第22讲化学平衡的移动课件,共60页。PPT课件主要包含了相同条件,考点2化学平衡移动,不发生,正反应,逆反应,p′乙=2p乙,p′丙=2p丙,答案甲乙=丙丁,等效平衡的应用,答案07a等内容,欢迎下载使用。












