






苏教版高考化学一轮复习8溶液中的离子反应第24讲水的电离和溶液的酸碱性课件
展开【课标要求】 1.了解水的电离、离子积常数。2.了解溶液pH的含义及其测定方法,能进行pH的简单计算。
H2O+H2O⇌H3O++OH-
H2O⇌H++OH-
Kw=c(H+)·c(OH-)
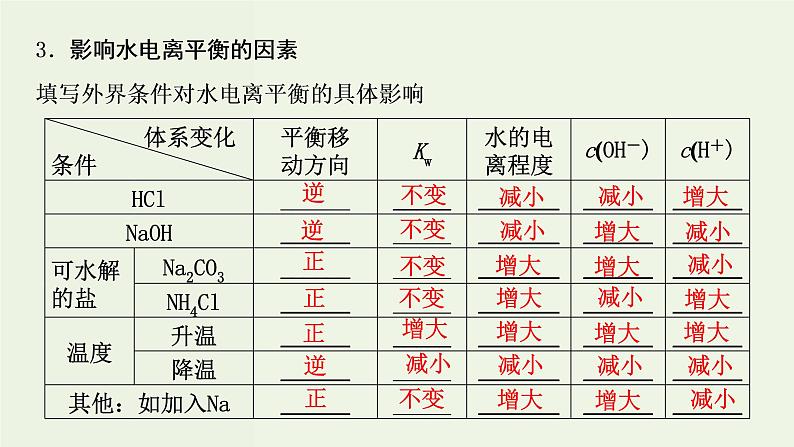
解析:②③分别为碱、酸,抑制水的电离;④中 水解促进水的电离;①NaCl不影响水的电离。
考点2 溶液的酸碱性与pH
3.pH的测定(1)pH试纸方法:取一小片试纸放在洁净的_________或__________上,用__________蘸取待测液点在试纸的中央,变色稳定后与标准比色卡对照,即可确定溶液的pH。(2)pH计测量法。
答案:pH试纸使用前不能用蒸馏水润湿,否则待测液因被稀释可能产生误差;用pH试纸读出的pH只能是整数;不能用pH试纸测定氯水的pH,因为氯水呈现强氧化性(漂白性)
用广范pH试纸测溶液的pH时应注意什么问题?记录数据时又要注意什么?是否可用广范pH试纸测定氯水的pH?________________________________________________________。
答案:(1)1×10-13 (2)①1∶10 ②10∶1
1.实验原理(1)原理:用已知浓度的酸(或碱)滴定未知浓度的碱(或酸),根据中和反应的等量关系来测定酸(或碱)的浓度。(2)实验关键①准确测定____________的体积。②准确判断______________。
(2)试剂标准液、待测液、指示剂、蒸馏水。(3)滴定管。①构造:“0”刻度线在上方,尖嘴部分无刻度。②精确度:读数可估计到________ mL。③洗涤:先用蒸馏水洗涤,再用_______液润洗。④排泡:酸、碱式滴定管中的液体在滴定前均要排出尖嘴中的气泡。
3.实验操作(以标准盐酸滴定待测NaOH溶液为例)(1)滴定前的准备①滴定管:______→蒸馏水洗涤→用________润洗→装液→排泡→调液面→记录。②锥形瓶:蒸馏水洗涤→装液→加指示剂。
(1)KMnO4溶液应用碱式滴定管盛装。( )(2)用碱式滴定管准确量取20.00 mL的NaOH溶液。( )(3)将液面在0 mL处的25 mL的酸式滴定管中的液体全部放出,液体的体积为25 mL。( )(4)中和滴定操作中所需标准溶液越浓越好,指示剂一般加入2~3 mL。( )
(5)中和滴定实验时,滴定管、锥形瓶均用待装液润洗。( )(6)滴定终点就是酸碱恰好中和的点。( )(7)滴定管盛标准溶液时,调液面一定要调到“0”刻度。( )(8)滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁。( )
滴定终点的判断(1)用a ml·L-1的HCl滴定未知浓度的NaOH溶液,用酚酞做指示剂,达到滴定终点的现象是_____________________________________。若用甲基橙做指示剂,滴定终点现象是_________________________。(2)用标准碘溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,应选用________做指示剂,达到滴定终点的现象是___________________。
答案:(1)滴入最后一滴标准液,溶液由红色变为无色,且半分钟内不恢复红色 当滴入最后一滴标准液,溶液由黄色变为橙色,且半分钟内不恢复黄色(2)淀粉溶液 当滴入最后一滴标准液,溶液由无色变为蓝色,且半分钟内不褪色(3)否 当滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,且半分钟内不褪色
(3)用标准酸性KMnO4溶液滴定溶有SO2的水溶液,以测定水中SO2的含量,是否需要选用指示剂________________(填“是”或“否”),达到______滴定终点的现象是____________________________________。
2.实验室现有3种酸碱指示剂,其pH变色范围如下:甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0用0.100 0 ml·L-1NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述正确的是( )A.溶液呈中性,可选用甲基橙或酚酞做指示剂B.溶液呈中性,只能选用石蕊做指示剂C.溶液呈碱性,可选用甲基橙或酚酞做指示剂D.溶液呈碱性,只能选用酚酞做指示剂
解析:NaOH溶液和CH3COOH溶液恰好反应生成CH3COONa时,CH3COO-水解显碱性,而酚酞的变色范围为8.2~10.0,比较接近。
指示剂选择的基本原则变色要灵敏,变色范围要小,使变色范围尽量与滴定终点溶液的酸碱性一致。1.不能用石蕊做指示剂。2.滴定终点为碱性时,用酚酞做指示剂。3.滴定终点为酸性时,用甲基橙做指示剂,例如用盐酸滴定氨水。4.强酸滴定强碱一般用甲基橙,但用酚酞也可以。
题组二 滴定数据的处理和误差分析3.某学生用0.200 0 ml·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数;④移取20.00 mL待测液注入洁净的锥形瓶中,并加入2滴酚酞溶液;⑤用标准液滴定至终点,记下滴定管液面读数。
答案:(1)① 偏大 (2)0.200 0
请回答:(1)以上步骤有错误的是________(填序号),该错误操作会导致测定结果________(填“偏大”“偏小”或“无影响”)。(2)根据下列数据:请计算待测盐酸溶液的浓度为________ ml/L。
4.用标准盐酸溶液滴定未知浓度的NaOH溶液(酚酞作指示剂),用“偏高”“偏低”或“无影响”填空。(1)酸式滴定管未用标准溶液润洗。________。(2)锥形瓶用待测溶液润洗。________。(3)锥形瓶洗净后还留有蒸馏水。________。(4)放出碱液的滴定管开始有气泡,放出液体后气泡消失。________。(5)酸式滴定管滴定前有气泡,滴定终点时气泡消失。________。(6)部分酸液滴出锥形瓶外。________。(7)酸式滴定管滴定前读数正确,滴定后俯视读数(或前仰后俯)。________。(8)酸式滴定管滴定前读数正确,滴定后仰视读数(或前俯后仰)。________。
答案:(1)偏高 (2)偏高 (3)无影响 (4)偏低 (5)偏高 (6)偏高 (7)偏低 (8)偏高
滴定曲线(pH曲线)分析
[提醒] 恰好中和=酸碱恰好完全反应≠滴定终点≠溶液呈中性。
解析:由于稀氨水显碱性,首先排除选项A和C;两者恰好反应时溶液显酸性,排除选项D。
3.如图曲线a和b是盐酸与NaOH的相互滴定的滴定曲线,下列叙述正确的是( )A.盐酸的物质的量浓度为1 ml·L-1B.P点时反应恰好完全,溶液呈中性C.曲线a是盐酸滴定NaOH的滴定曲线D.酚酞不能用作本实验的指示剂
解析:根据曲线a知,滴定前盐酸的pH=1,c(HCl)=0.1 ml·L-1,A错误;P点表示盐酸与NaOH恰好完全中和,溶液呈中性,B正确;曲线a是NaOH溶液滴定盐酸的曲线,曲线b是盐酸滴定NaOH溶液的曲线,C错误;强酸与强碱相互滴定,可以用酚酞作指示剂,D错误。
滴定实验的类型与计算技巧
1.酸碱中和滴定[典例1] 海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:(1)气提、吸收CO2,用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如下)。
[答案] (2)xy/z
2.氧化还原滴定[典例2] 水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。
Ⅱ.测定步骤a.安装装置,检验气密性,充N2排尽空气后,停止充N2。b.向烧瓶中加入200 mL水样。c.向烧瓶中依次迅速加入1 mL MnSO4无氧溶液(过量)、2 mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。d.搅拌并向烧瓶中加入2 mL硫酸无氧溶液至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00 mL溶液,以淀粉作指示剂,用0.010 00 ml/L Na2S2O3溶液进行滴定,记录数据。f.……g.处理数据(忽略氧气从水样中的溢出量和加入试剂后水样体积的变化)。回答下列问题:步骤e中达到滴定终点的标志为____________。若某次滴定消耗Na2S2O3溶液4.50 mL,水样的DO=________ mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标________(填“是”或“否”)。
[答案] 溶液蓝色褪去(且半分钟内不变色) 9.0 是
(3)(2015·高考广东卷)用稀NaOH滴定盐酸,用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定。( )(4)(2015·高考江苏卷)中和滴定时,滴定管用所盛装的反应液润洗2~3次。( )
2024年高考化学一轮复习课件(鲁科版)第8章 第45讲 水的电离和溶液的酸碱性: 这是一份2024年高考化学一轮复习课件(鲁科版)第8章 第45讲 水的电离和溶液的酸碱性,文件包含第8章第45讲水的电离和溶液的酸碱性pptx、第8章第45练水的电离和溶液的酸碱性docx、第8章第45讲水的电离和溶液的酸碱性docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
新教材适用2024版高考化学一轮总复习第8章水溶液中的离子反应与平衡第24讲水的电离和溶液的pH课件: 这是一份新教材适用2024版高考化学一轮总复习第8章水溶液中的离子反应与平衡第24讲水的电离和溶液的pH课件,共60页。PPT课件主要包含了考点一,考点二,考点三,考点一水的电离,必备知识·梳理夯实,×10-14,电解质,OH-,归纳拓展,cH+等内容,欢迎下载使用。
人教版高考化学一轮复习第8章水溶液中的离子平衡第2讲水的电离和溶液的酸碱性课件: 这是一份人教版高考化学一轮复习第8章水溶液中的离子平衡第2讲水的电离和溶液的酸碱性课件












