






人教版 (2019)必修 第一册实验活动1 配制一定物质的量浓度的溶液获奖ppt课件
展开质量分数0.9%的氯化钠溶液可作生理盐水。
在日常生活生产中,很多物质具有的特殊作用,在浓度上都是有要求的。例如
体积分数为75%的酒精溶液可用于杀菌消毒。
在初中,同学们学过了配制一定溶质质量分数的溶液,如何配制100g质量分数0.9%的NaCl溶液?
托盘天平、烧杯、量筒、玻璃棒
计算→称量→量取→溶解→装瓶
在实验室中,我们可以直接用固体或液体试剂来配制一定物质的量浓度的溶液。如果要求比较精确,就需使用容积精确的仪器,如容量瓶。
【学习任务一】容量瓶的使用
如果要配制980mL溶液,该选择什么规格的容量瓶呢?
4.使用前必须检查是否漏水。检查的方法是:往瓶内加入一定量的水,塞好瓶塞,把瓶倒立过来,观察瓶塞周围是否有漏水。如果不漏水,将瓶正立并将瓶塞旋转180°后塞紧,仍把瓶倒立,再检查是否漏水。均不漏水,则容量瓶良好。
5.“五不”原则:容量瓶不能加热,不能长时间存放溶液,不能溶解固体,不能稀释液体,不能当做反应的容器进行反应。
构造:细颈、平底玻璃瓶,
2. 标志:①瓶身标有温度和容积 ②瓶颈标有刻度线
3. 使用范围:准确控制配制溶液的体积
常见规格50mL,100mL,250mL,500mL,1000mL
选用原则:等大或稍大。
【学习任务二】配制一定物质的量浓度的溶液
实验目的:配制100mL1.00ml/L的NaCl溶液
实验仪器:100mL容量瓶、托盘天平、烧杯、玻璃棒、量筒、胶头滴管
配制100 mL 1.00 ml/LNaCl溶液—步骤
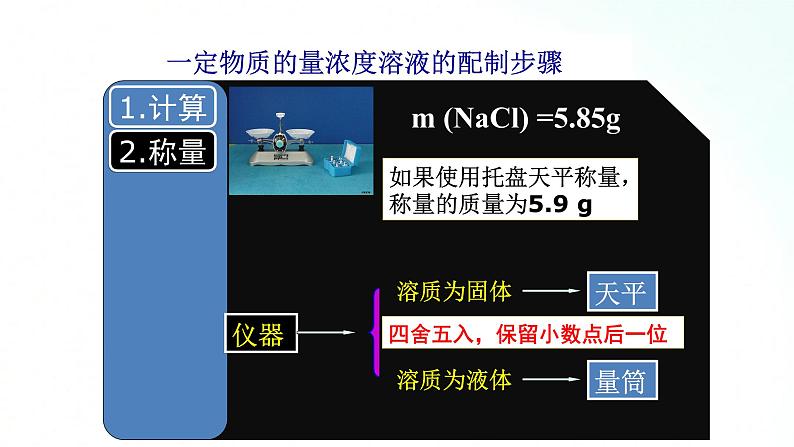
100mL1.00ml/LNaCl中NaCl的物质的量为: n(NaCl)=c(NaCl) · V[ NaCl(aq) ] =1.00ml/L×0.1L =0.1ml m (NaCl) =n(NaCl) ·M(NaCl) =0.1ml×58.5g/ml =5.85g
若配制80mL1.00ml/L的NaCl溶液,需要多少克NaCl固体?
5.85g,没有80mL的容量瓶,应选择100mL容量瓶,溶液体积以100mL计算。
一定物质的量浓度溶液的配制步骤
如果使用托盘天平称量,称量的质量为5.9 g
四舍五入,保留小数点后一位
m (NaCl) =5.85g
转移之前,溶液要先冷却至室温
①用少量蒸馏水洗涤烧杯内壁2~3次;②洗液应全部转移到容量瓶中;③轻轻摇动,使溶液充分混合。
确保溶质完全转移到容量瓶中
向容量瓶中注入蒸馏水,距刻度1-2cm处停止,改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切(这一操作称为定容)。
盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底边缘,把容量瓶倒转和摇动多次,使溶液混合均匀。
0.1ml/LNaCl
将配好的溶液倒入试剂瓶中,盖上瓶塞,贴上标签。
一定物质的量浓度溶液的配制
1.实验中需2 ml·L-1的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是A.1000mL,212g B.950mL,543.4g ( )C.任意规格,572g D.500mL,286g2.用已准确称量过的氯化钠固体配制1.00 ml·L-1的NaCl溶液0.5L,需要用的仪器是①坩埚 ②分液漏斗 ③容量瓶 ④烧杯 ⑤胶头滴管 ⑥烧瓶⑦玻璃棒 ⑧托盘天平 ⑨药匙 ( ) A.③④⑤⑦⑨ B.①②⑤⑥⑧ C.③④⑤⑦ D.③④⑤⑥
3.实验室需要用480 mL 0.1 ml·L-1的硫酸铜溶液,以下配制方法正确的是( )A.称取12.5 g胆矾(CuSO4·5H2O),配成500 mL溶液B.称取12.5 g胆矾(CuSO4·5H2O),加入500 mL水配成溶液C.称取7.68 g无水硫酸铜粉末,加入480 mL水配成溶液D.称取8.0 g无水硫酸铜粉末,加入500 mL水配成溶液
[解析] 取500 mL 容量瓶配制 0.1 ml·L-1 CuSO4溶液,称取胆矾的质量为0.1 ml·L-1×0.5 L×250 g·ml-1=12.5 g,称取无水硫酸铜粉末的质量为 0.1 ml·L-1×0.5 L×160 g·ml-1=8.0 g,最后要加水配成500 mL 溶液。
4.用36.5%的浓盐酸(密度1.2 g·cm-3)配制 100 mL 1 ml·L-1的稀盐酸,配制过程需用到哪些仪器,且先后顺序正确的是( )①100 mL量筒 ②10 mL量筒 ③50 mL 烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒A.①③⑤⑥⑦ B.②⑥③⑦⑤⑥C.③⑤⑦⑥① D.④③⑦⑤⑥
5.实验室用固体烧碱配制500mL0.1ml/LNaOH溶液。(1)需称取 g烧碱固体,固体应放在 中称量(2)配制过程中一定不需要的仪器是 。 A.烧杯 B.量筒 C.玻璃棒 D.1000mL容量瓶 E.锥形瓶 F.胶头滴管 G.500mL试剂瓶
(3)根据实验的实验需要和(2)中列出的仪器判断完成实验还缺少的仪器是 _____。(4)在准确确定溶液体积过程中,完成后期加入少量水的正确做法是 。
500mL容量瓶、天平
向容量瓶中加蒸馏水,距刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。
凡是使m 或n 减小的因素,都使c 偏小;
凡是使V 增大的因素,都使c 偏小;
凡是使V 减小的因素,都使c 偏大。
凡是使m 或n 增大的因素都使c 偏大;
【学习任务三】误差分析
实验过程中,有哪些操作会对配制溶液的浓度造成误差呢?请同学们完成课本P56【思考与讨论】
1. 称量时左盘高,右盘低
2. 称量时称量物放在右盘,而砝码放在左盘(使用了游码)
3. 量筒量取液体药品时仰视读数
4. 量筒量取液体药品时俯视读数
若称量时物品放到了右盘,质量是12.8g。则实际质量为 g
5. 溶解过程中有少量液体溅出烧杯
6. 未洗涤溶解用的玻璃棒和烧杯
7. 洗涤液未转入容量瓶中而倒入废液缸中
仰视读数:加水多了,溶液体积(V)偏大
俯视读数:加水少了,溶液体积(V)偏小
10. 定容时液面低于刻度线
11. 未等溶液冷却就定容
12. 定容后发现液面高于刻度线后,用滴管吸出少量溶液
13. 摇匀后发现液面低于刻度再加水
14. 原容量瓶洗净后未干燥
15. 容量瓶中含有少量的水
16. 往容量瓶中加水时有少量加到瓶外
1.用质量分数为36.5%的浓盐酸(密度为 1.16 g·cm-3)配制成1 ml·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:(1)配制稀盐酸时,应选用规格为 mL的容量瓶。
(2)经计算需要 mL浓盐酸,在量取时宜选用下列量筒中的 。 A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:①等稀释的盐酸冷却至室温后,沿玻璃棒注入容量瓶中。②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm 时,改用胶头滴管加蒸馏水,使溶液的凹液面与瓶颈的刻度线相切。③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。上述操作中,正确的顺序是(填序号) 。
(4)其操作步骤如图 (a)所示,则如图(b)所示操作应在图(a)中的 (填选项字母)之间。
[解析]根据溶液配制步骤:称量→溶解→转移→洗涤→定容→摇匀,结合图示步骤,向容量瓶中直接加蒸馏水的操作应在洗涤之后、定容操作之前,即在④与⑤之间。
A.②和③B.①和② C.④和⑤D.③和④
(5)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度 (填“偏高”“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度 (填“偏高”“偏低”或“无影响”)。
[解析]在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,会将浓盐酸稀释,导致所取的盐酸的量偏小,则其配制的稀盐酸浓度偏低;若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,会造成溶质的损失,则配制的稀盐酸浓度偏低。
人教版 (2019)必修 第一册第三节 物质的量课堂教学课件ppt: 这是一份人教版 (2019)必修 第一册第三节 物质的量课堂教学课件ppt,共23页。PPT课件主要包含了物质的量浓度,符号cB,溶液混合的计算公式,课堂练习等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第三节 物质的量多媒体教学ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三节 物质的量多媒体教学ppt课件,共25页。
人教版 (2019)必修 第一册第三节 物质的量教学ppt课件: 这是一份人教版 (2019)必修 第一册第三节 物质的量教学ppt课件,共27页。PPT课件主要包含了cB溶液,×Vaq,÷Vaq等内容,欢迎下载使用。













