



还剩7页未读,
继续阅读
所属成套资源:人教版(2019)高中化学必修一PPT课件(共38份)
成套系列资料,整套一键下载
人教版化学必修一 第三章 基础知识复习 课件
展开
这是一份人教版化学必修一 第三章 基础知识复习 课件,共13页。
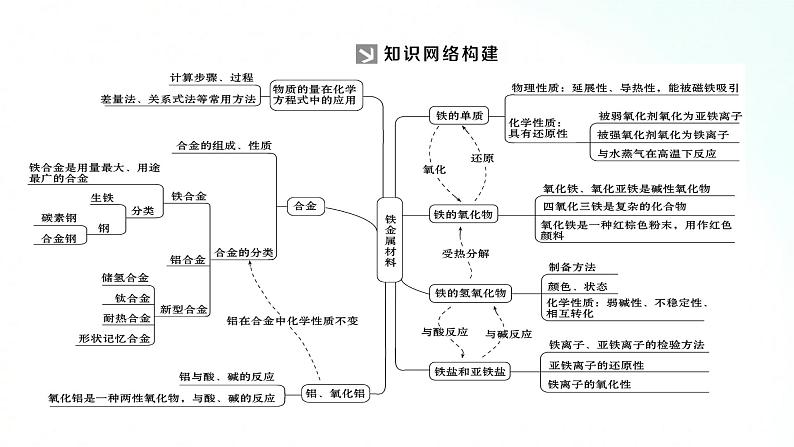
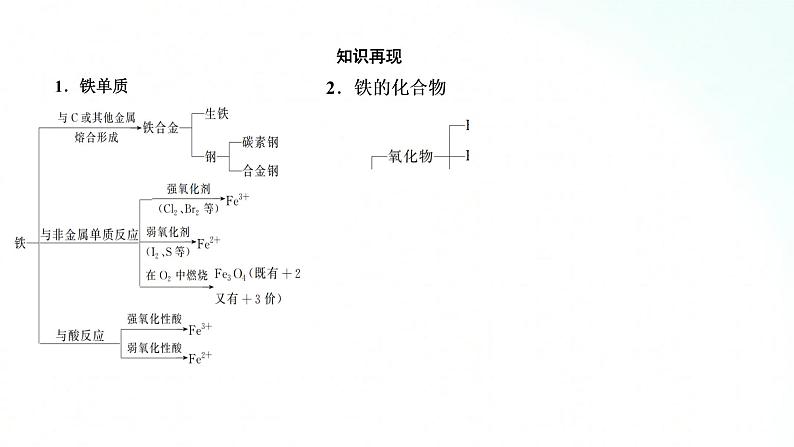
人教版化学必修一铁、金属材料基础知识复习课2.铝及其化合物之间的相互转化【整合提升】一、铁 铝及其化合物之间的相互转化1.铁及其化合物之间的相互转化知识再现1.铁单质3、铁的化合物4、铝及铝合金二、金属材料三.物质的量在化学方程式计算中的应用(1)计算公式提示:(2)计算过程提示:突破点一 Fe3+、Fe2+、Cu、Fe之间的转化【典例1】 已知Cu+2Fe3+===Cu2++2Fe2+,Zn+2Fe3+===Zn2++2Fe2+,现把等物质的量的CuSO4、FeCl3和Zn三种物质置于盛有水的容器中,充分反应后,容器中除SO42-、Cl-外还有( )A.Zn2+、Cu、Fe2+B.Zn2+、Cu2+、Fe、Fe2+C.Zn2+、Cu2+、Fe2+D.Zn2+、Cu2+、Cu、Fe2+[思路启迪] (1)切入点:要考虑到一种金属与多种阳离子发生反应时,阳离子按氧化性由强到弱的顺序发生反应。按发生反应的先后排序,结合题中的“量”推算反应的最终产物。(2)关键点:正确分析反应的先后顺序。在同一溶液中,当发生氧化还原反应时,一定是氧化性最强的物质先与还原剂反应。另外在求解过程中还要考虑各反应物之间量的关系。[解析] 设CuSO4、FeCl3和Zn的物质的量均为1 mol,由题中所给的反应式可得出氧化性:Fe3+>Cu2+,所以Zn先与Fe3+反应,1 mol Fe3+消耗0.5 mol Zn;剩余的0.5 mol Zn能置换出0.5 mol Cu,溶液中还剩余0.5 mol Cu2+,即充分反应后,容器中还含有Fe2+、Zn2+、Cu2+、Cu。[答案] D判断化学反应先后顺序的方法(1)一种氧化剂与多种还原剂反应,还原性强的还原剂优先发生反应。如向含等物质的量浓度的碘化亚铁、溴化亚铁溶液中缓慢通入氯气,发生反应的先后顺序为I-、Fe2+、Br-。(2)一种还原剂与多种氧化剂反应,氧化性强的氧化剂优先发生反应。如在含等物质的量浓度的H+、Fe2+、Fe3+、Cu2+、Zn2+的溶液中加入镁粉,反应的先后顺序为Fe3+、Cu2+、H+、Fe2+、Zn2+。(3)一种碱与多种阳离子反应,生成物越难电离,越先发生反应。如在含等物质的量浓度的H+、Fe3+、NH4+的溶液中滴加氢氧化钠溶液,发生反应的先后顺序为H+、Fe3+、NH4+。突破点二 Fe(OH)2的制备【典例2】 用下面两种方法可以制得白色的Fe(OH)2沉淀。方法一:用FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。(1)除去蒸馏水中溶解的O2常采用________的方法。(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_____________________________________。方法二:在如图所示装置中,用不含O2的NaOH溶液、铁屑和稀硫酸制备。(1)在试管Ⅰ里加入的试剂是________。(2)在试管Ⅱ里加入的试剂是________。(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是________。(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_________________________________。[思路启迪] (1)切入点:熟悉Fe(OH)2的制备原理是Fe2++2OH-===Fe(OH)2↓。(2)关键点:要特别注意Fe(OH)2在空气中极易被氧化为Fe(OH)3,所以制备时一定要保证为无氧环境。[解析] 方法一:(1)气体的溶解度是随温度升高而降低的,所以煮沸后的蒸馏水中溶解的O2变少。(2)避免生成的Fe(OH)2被空气(氧气)氧化。方法二:试管Ⅱ是开口式,无法利用产生的气体将溶液压入试管Ⅰ中,所以制取FeSO4应在试管Ⅰ中进行,而在试管Ⅱ中应加入不含O2的NaOH溶液。当把Fe与稀硫酸放入试管Ⅰ后,产生的H2可通过试管Ⅰ内的短导管排出试管Ⅰ内的空气,然后经过止水夹进入试管Ⅱ中,再排尽试管Ⅱ内的空气,最后关闭止水夹,试管Ⅰ内产生的H2无法逸出,H2产生的压强将试管Ⅰ内生成的FeSO4溶液通过长导管压入试管Ⅱ内,在此过程中,液体都处于H2环境中,从而避免了空气中的O2将反应生成的Fe(OH)2氧化成Fe(OH)3。[答案] 方法一:(1)煮沸 (2)避免生成的Fe(OH)2沉淀接触O2而被氧化方法二:(1)稀硫酸、铁屑 (2)NaOH溶液(3)检验试管Ⅱ出口处排出的H2的纯度,当排出的H2纯净时,再夹紧止水夹(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入装置(1)Fe2+极易被氧化,所以FeSO4溶液要现用现配。(2)为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2。(3)为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。(4)为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气。谢谢观看
人教版化学必修一铁、金属材料基础知识复习课2.铝及其化合物之间的相互转化【整合提升】一、铁 铝及其化合物之间的相互转化1.铁及其化合物之间的相互转化知识再现1.铁单质3、铁的化合物4、铝及铝合金二、金属材料三.物质的量在化学方程式计算中的应用(1)计算公式提示:(2)计算过程提示:突破点一 Fe3+、Fe2+、Cu、Fe之间的转化【典例1】 已知Cu+2Fe3+===Cu2++2Fe2+,Zn+2Fe3+===Zn2++2Fe2+,现把等物质的量的CuSO4、FeCl3和Zn三种物质置于盛有水的容器中,充分反应后,容器中除SO42-、Cl-外还有( )A.Zn2+、Cu、Fe2+B.Zn2+、Cu2+、Fe、Fe2+C.Zn2+、Cu2+、Fe2+D.Zn2+、Cu2+、Cu、Fe2+[思路启迪] (1)切入点:要考虑到一种金属与多种阳离子发生反应时,阳离子按氧化性由强到弱的顺序发生反应。按发生反应的先后排序,结合题中的“量”推算反应的最终产物。(2)关键点:正确分析反应的先后顺序。在同一溶液中,当发生氧化还原反应时,一定是氧化性最强的物质先与还原剂反应。另外在求解过程中还要考虑各反应物之间量的关系。[解析] 设CuSO4、FeCl3和Zn的物质的量均为1 mol,由题中所给的反应式可得出氧化性:Fe3+>Cu2+,所以Zn先与Fe3+反应,1 mol Fe3+消耗0.5 mol Zn;剩余的0.5 mol Zn能置换出0.5 mol Cu,溶液中还剩余0.5 mol Cu2+,即充分反应后,容器中还含有Fe2+、Zn2+、Cu2+、Cu。[答案] D判断化学反应先后顺序的方法(1)一种氧化剂与多种还原剂反应,还原性强的还原剂优先发生反应。如向含等物质的量浓度的碘化亚铁、溴化亚铁溶液中缓慢通入氯气,发生反应的先后顺序为I-、Fe2+、Br-。(2)一种还原剂与多种氧化剂反应,氧化性强的氧化剂优先发生反应。如在含等物质的量浓度的H+、Fe2+、Fe3+、Cu2+、Zn2+的溶液中加入镁粉,反应的先后顺序为Fe3+、Cu2+、H+、Fe2+、Zn2+。(3)一种碱与多种阳离子反应,生成物越难电离,越先发生反应。如在含等物质的量浓度的H+、Fe3+、NH4+的溶液中滴加氢氧化钠溶液,发生反应的先后顺序为H+、Fe3+、NH4+。突破点二 Fe(OH)2的制备【典例2】 用下面两种方法可以制得白色的Fe(OH)2沉淀。方法一:用FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。(1)除去蒸馏水中溶解的O2常采用________的方法。(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_____________________________________。方法二:在如图所示装置中,用不含O2的NaOH溶液、铁屑和稀硫酸制备。(1)在试管Ⅰ里加入的试剂是________。(2)在试管Ⅱ里加入的试剂是________。(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是________。(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_________________________________。[思路启迪] (1)切入点:熟悉Fe(OH)2的制备原理是Fe2++2OH-===Fe(OH)2↓。(2)关键点:要特别注意Fe(OH)2在空气中极易被氧化为Fe(OH)3,所以制备时一定要保证为无氧环境。[解析] 方法一:(1)气体的溶解度是随温度升高而降低的,所以煮沸后的蒸馏水中溶解的O2变少。(2)避免生成的Fe(OH)2被空气(氧气)氧化。方法二:试管Ⅱ是开口式,无法利用产生的气体将溶液压入试管Ⅰ中,所以制取FeSO4应在试管Ⅰ中进行,而在试管Ⅱ中应加入不含O2的NaOH溶液。当把Fe与稀硫酸放入试管Ⅰ后,产生的H2可通过试管Ⅰ内的短导管排出试管Ⅰ内的空气,然后经过止水夹进入试管Ⅱ中,再排尽试管Ⅱ内的空气,最后关闭止水夹,试管Ⅰ内产生的H2无法逸出,H2产生的压强将试管Ⅰ内生成的FeSO4溶液通过长导管压入试管Ⅱ内,在此过程中,液体都处于H2环境中,从而避免了空气中的O2将反应生成的Fe(OH)2氧化成Fe(OH)3。[答案] 方法一:(1)煮沸 (2)避免生成的Fe(OH)2沉淀接触O2而被氧化方法二:(1)稀硫酸、铁屑 (2)NaOH溶液(3)检验试管Ⅱ出口处排出的H2的纯度,当排出的H2纯净时,再夹紧止水夹(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入装置(1)Fe2+极易被氧化,所以FeSO4溶液要现用现配。(2)为了防止Fe2+被氧化,配制FeSO4溶液的蒸馏水和NaOH溶液要煮沸,尽可能除去O2。(3)为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。(4)为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物,以隔绝空气。谢谢观看
相关资料
更多









