






高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡一等奖ppt课件
展开1.知道化学平衡常数的含义,会根据化学反应书写化学平衡常数表达式。 2. 能够利用化学平衡常数进行简单的计算 。 3.应用化学平衡常数和浓度商的关系判断化学反应是否达到平衡及反应进行的方向,提升从定量的角度分析化学反应的能力。
知识回顾:化学平衡状态(化学平衡)
在一定条件下,可逆反应体系中,当正、逆反应的速率相等时,反应物浓度和生成物浓度均保持不变,即体系的组成不随时间的而改变,这表明该反应的转化达到了“限度”这时的状态称之为化学平衡状态,简称化学平衡。
当达到化学平衡状态时究竟有多少反应物转化成生成物?平衡体系中反应物的浓度和生成物的浓度之间有什么关系呢?
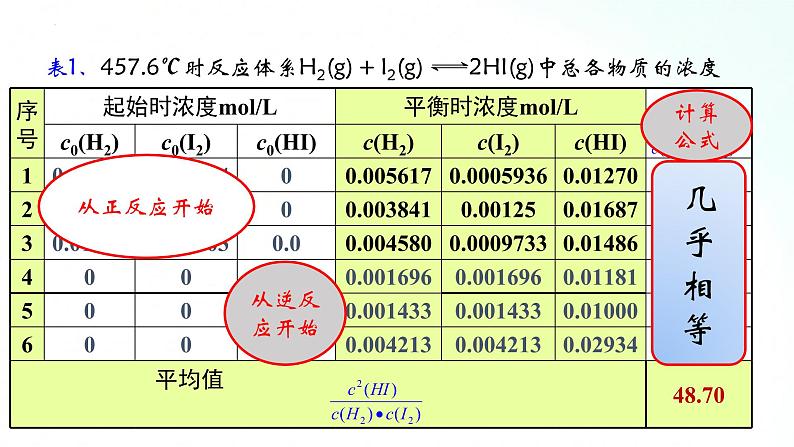
分析课本P31页表2—1
1、温度不变时,反应达到平衡, 为常数 用K表示;2、常数K与反应的起始浓度大小无关;3、常数K与正向建立还是逆向建立平衡无关即与平衡建立的过程无关。
通过分析实验数据得出:
H2(g) + I2(g) 2HI(g)
3H2(g) + N2(g) 2NH3(g)
总结:表达式与化学反应方程式的关系
结论:生成物浓度幂之积与反应物浓度幂之积的比值
在任意时刻,生成物浓度幂之积与反应物浓度幂之积的比值,称为浓度商,常用Q表示。
平衡时的浓度商称化学平衡常数
在一定温度下,当一个可逆反应达到平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,该常数就是该反应的化学平衡常数(简称平衡常数),用符号K表示。
②当Q=K 说明已达到平衡状态。
①表达式相同。Q中任意时刻的各组分的浓度而K平衡浓度
课堂练习1、写出下列可逆反应的K的表达式
(1)反应物或生成物中有固体或纯液体存在时,由于其浓度可看作“1”而不代入公式。(2)水的处理 ①气态水或非水溶液中的反应,如有水生成或有水参加反应,此时水的浓度不可视为常数。 ②稀溶液中进行的反应,如有水参加,水的浓度视为常数“ 1”而不代入公式
3、书写化学平衡常数关系式注意事项
K与方程式的书写有关;
课堂练习2、写出下列可逆反应的化学平衡常数的表达式
K1=1/K2=K32
(3)化学平衡常数是指某一具体反应的平衡常数。 ①若反应方向改变,则平衡常数改变。 ②若化学方程式中各物质的化学计量数成比例扩大或缩小n倍,尽管是同一反应,平衡常数也会改变。
方程①+ ②= ③ 则有
方程③ — ②= ①则有
(4)多个反应合并的平衡常数之间的关系若干方程式相加(减),则总反应的平衡常数 等于分步平衡常数之乘积(商)
K值越大,说明平衡体系中生成物所占的比例_________,它的正向反应进行的程度________,即该反应进行得越________,反应物转化率________;反之,正向反应进行的程度就越________,转化率就________。一般地说,________时,该反应进行得就基本完全了。
4、化学平衡常数的意义
观察下表,思考为什么不同反应之间的K值相差如此之大?
5、化学平衡常数影响因素
外因: 同一个化学反的平衡常数不受浓度的影响,只受温度影响
内因:平衡常数的大小,主要与反应中物质的性质有关
分析表4总结外因的影响因素
放热反应:T升高K减小 吸热反应: T升高K增大
课堂练习4、在一定条件下,二氧化硫和氧气发生如下反应: 2SO2(g)+O2 (g)⇌2SO3(g) (1)写出该反应的化学平衡常数表达式K=_______________. (2)降低温度,K值增大,判断该反应是________(“放热” 或“吸热” )反应。(3)二氧化硫转化率______,化学反应速率______(以上均填增大、减小或不变).
平衡常数的大小可以 判断反应进行的程度,受温度的影响可以判断该反应的热效应。
二、化学平衡常数的应用
(1)、判断反应进行的方向;
Q>K, v正<v逆,反应向逆方向进行
[例题1]在某温度下,将H2和I2各0.10ml气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080ml/L(1)求该反应的平衡常数(2)在上述温度下,该容器中若通入H2和I2蒸气各 0.20ml,试求达到化学平衡状态时各物质的浓度
(2)化学平衡常数的相关计算
(1).已知初始浓度和平衡浓度求平衡常数
三段式法——“始、变、平、列方程”
(2).知平衡常数和初始浓度求平衡浓度
C(H2)=C(I2)=0.016ml/L C(HI)=0.008ml/L
除了化学平衡常数外,还有没有其他方法能用来表示化学反应进行的限度呢?
平衡常数和转化率的计算
(3)知平衡常数和初始物质的量求转化率
⑴基本模式——“三段法”起、转、平
转化浓度:mx nx px qx
平衡浓度:a-mx b-nx px qx
②生成物:平衡浓度=起始浓度+转化浓度
①反应物:平衡浓度=起始浓度-转化浓度
例: mA + nB pC + qD 起始浓度:a b 0 0
化学平衡的相关计算方法
各物质的变化浓度之比=化学计量系数之比
c(CO) : c(H2O) = 1:1 时 CO + H2O CO2 + H2 起始c 1 1 0 0转化c -x -x +x +x平衡c 1-x 1-x x x 解得 x = 0.5 α(CO)= 50% α(H2O)= 50%
c(CO) : c(H2O) = 1:4 时 CO + H2O CO2 + H2 起始c 1 4 0 0转化c -x -x +x +x平衡c 1-x 4-x x x解得 x = 0.8 α(CO)= 80% α(H2O)= 20%
课堂练习6、已知CO(g) + H2O(g) CO2 (g) +H2 (g) 800℃ K = 1.0 ;求恒温恒容体系中,用c(CO):c(H2O)=1:1或1:4开始,达到平衡时CO和H2O(g)的转化率。
增大一种反应物的浓度,能提高另一种反 应物的转化率,而本身的转化率减小
用浓度商Q与K比较:Q<K,反应向正反应方向移动;Q=K,反应处于平衡状态;Q>K,反应向逆反应方向移动
三段式做有关计算题方法
K越大,反应进行程度越大。只与温度有关
1.下列关于平衡常数K的说法中,正确的是( )①平衡常数K只与反应本身及温度有关 ②改变反应物浓度或生成物浓度都会改变平衡常数K ③加入催化剂不改变平衡常数K ④平衡常数K只与温度有关,与反应的本身及浓度、压强无关A.①② B.②③ C.③④ D.①③
2.在某温度下,可逆反应:mA(g)+nB(g) pC(g) + qD(g)的平衡常数为K,下列说法正确的是( )A.K越大,达到平衡时,反应进行的程度越大.B.K越小,达到平衡时,反应物的转化率越大.C.K随反应物浓度改变而改变.D.K随温度改变而改变.
3、已知方程式A(g) ⇌ C(g) K1 和 B(g) ⇌ D(g) K2 用K1、K2表示下列反应的平衡常数。(1)C(g) ⇌ A(g) K3 = __________(2)2B(g) ⇌ 2D(g) K4 = __________(3)A(g) + B(g) ⇌ C(g) + D(g) K5 = __________(4)2A(g) + D(g) ⇌ B(g) + 2C(g) K6 = __________
4、现有一定温度下的密闭容器中存在如下反应:
2SO2+O2 2SO3
知c(SO2)始=0.4ml/L,c(O2)始=1ml/L经测定该反应在该温度下的平衡常数K≈19,试判断,(1)当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,哪个方向进行?(2)达平衡状态时, SO2的转化率应为多少?
5、反应SO2(g)+ NO2(g) SO3(g)+NO(g) ,若在一定温度下,将物质的量浓度均为2ml/L的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为60%,试求:在该温度下。(1)此反应的浓度平衡常数。(2)若SO2(g)的初始浓度增大到3ml/L,则SO2(g)和NO2(g)的转化率分别变为多少?
47.6% 74%
人教版 (2019)选择性必修1第二节 化学平衡教课课件ppt: 这是一份人教版 (2019)选择性必修1第二节 化学平衡教课课件ppt,共36页。PPT课件主要包含了c2HI,结论2,结论1,结论3,查阅文献,化学平衡常数,影响因素,主要因素,后一节深入学习,平衡常数的计算等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡集体备课课件ppt: 这是一份人教版 (2019)选择性必修1第二节 化学平衡集体备课课件ppt,共15页。
高中人教版 (2019)第二章 化学反应速率与化学平衡第二节 化学平衡备课课件ppt: 这是一份高中人教版 (2019)第二章 化学反应速率与化学平衡第二节 化学平衡备课课件ppt,共36页。PPT课件主要包含了化学平衡常数,称为浓度商,c为平衡浓度,c为任一时刻浓度,一定温度下,某温度下,模块三速率常数,压强平衡常数,p分压,第三段等内容,欢迎下载使用。













