





人教版 (2019)必修 第一册第二节 离子反应多媒体教学ppt课件
展开目录 CONTENT
理解电解质的概念,了解常见的电解质,培养宏观辨识与微观探析的能力和素养
认识酸、碱、盐等电解质的电离
能用电离方程式表示某些酸、碱、盐的电离
能从不同层次认识物质的多样性,并对物质进行分类
知道可以通过分析、推理等方法认识研究对象的本质特征
建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律
生活常识告诉我们,给电线设备通电时,湿手操作容易发生触电事故。这是为什么呢?
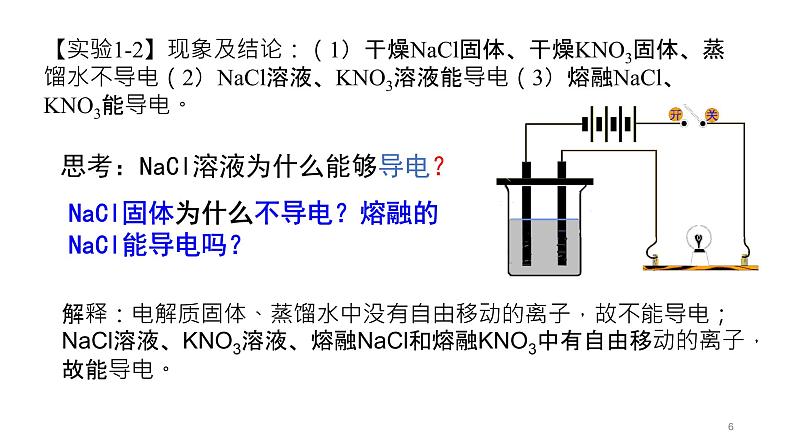
(1)实验操作将如图装置中的样品依次更换为NaCl固体、KNO3固体、蒸馏水、NaCl溶液、KNO3溶液。
【实验1-2】现象及结论:(1)干燥NaCl固体、干燥KNO3固体、蒸馏水不导电(2)NaCl溶液、KNO3溶液能导电(3)熔融NaCl、KNO3能导电。
解释:电解质固体、蒸馏水中没有自由移动的离子,故不能导电;NaCl溶液、KNO3溶液、熔融NaCl和熔融KNO3中有自由移动的离子,故能导电。
思考:NaCl溶液为什么能够导电?
NaCl固体为什么不导电?熔融的NaCl能导电吗?
(1)电解质:在________里或____________下能够导电的________。(2)非电解质:在________________________都不能够导电的________。
常见的电解质和非电解质(1)常见的电解质。①酸:HCl、H2SO4、HNO3 等。②碱:KOH、NaOH、NH3·H2O等。③盐:KCl、Na2SO4、Mg(NO3)2等。④活泼金属氧化物:Na2O、CaO等。⑤水
(2)常见的非电解质。①部分________________:CO2、SO2、SO3、P2O5等。②非酸性气态氢化物:NH3。③大部分___________:蔗糖、酒精、CH4
根据定义,判断下列说法是否正确?① 铁能导电,所以铁是电解质;液溴不能导电,它是非电解质。② CO2的水溶液能导电,所以CO2是电解质。③ CaCO3难溶于水,是非电解质。④ 铜丝、NaCl溶液和盐酸都能导电,所以三者都是电解质( )⑤ NH3、CO2的水溶液能导电,所以NH3、CO2均是电解质( )
注意: (1)能导电的物质不一定是电解质(如金属、石墨、盐酸等),电解质不一定能导电。(2)电解质、非电解质都必须是化合物;(3)电解质是化合物,而电解质溶液是混合物;如:盐酸是电解质溶液,HCl是电解质(4)电解质一定是自身能电离产生离子;在水溶液里能导电的化合物,不一定是电解质;如:CO2、SO2、SO3、NH3属于非电解质(5)电解质与其溶解性无关;如: BaSO4、AgCl 等是电解质
电解质的电离及溶液导电能力的判断(1)实质:电离的内因是电解质本身具有离子或具有能产生离子的内部结构,外因是水分子的作用或受热熔化。(2)条件:溶于水或熔融状态。(3)有关电解质的强弱必须注意以下两点①电解质的强弱与其溶解度的大小无关。某些难溶于水的盐,由于溶于水的部分完全电离,它们属于强电解质,如BaSO4、CaCO3等。
强电解质和弱电解质(1)强电解质①概念:在水溶液中能完全电离的电解质。强酸、强碱、大部分盐等都是强电解质。
(2)弱电解质①概念:在水溶液中部分电离的电解质。______________等都是弱电解质。
注意:弱电解质部分电离成自由移动的离子,电离的离子也可以结合成弱电解质。
1.电离的概念 电解质__________或________________时,形成的自由移动的离子 过程叫做电离。
2.电离方程式 电离方程式是用__________________表示电解质电离过程的式子。
水溶液中,NaCl在溶液中是以Na+ 、Cl-的形式存在的。熔融状态下,克服了离子之间的相互作用,产生了自由移动的Na+和Cl-。
①含义:表示电解质电离的式子。②书写要求:左边写电解质的化学式,右边写电离出的离子。
电离方程式书写注意事项(1)符合客观事实,不能随意书写离子符号,离子所带电荷数必须等于该元素或原子团在该化合物中的化合价。(2)质量守恒,即电离方程式左右两侧元素的种类、原子的个数相等。
写出下列酸、碱、盐的电离方程式。①硫酸(H2SO4):_______________________________________。②氢氧化钠(NaOH):___________________________________。③硫酸钠(Na2SO4):____________________________________。
(1)酸:电离时,生成的阳离子______________的化合物。
(2)碱:电离时,生成的阴离子________ __的化合物。
从电离的角度认识酸、碱、盐
(3)盐:电离时生成的阴离子是____________、阳离子是金属离子或铵根离子的化合物,如Na2SO4、NH4NO3等。
酸:H2SO4 === 2H+ + SO42-
碱:Ba(OH)2 === Ba2+ + 2OH-
盐:NH4Cl === NH4+ + Cl-
其实:酸、碱、盐在水溶液中的反应,实际上是它们电离产生的离子之间的反应。
凡是能电离出H+的物质一定是酸吗?
不一定,如NaHSO4溶液中可电离出H+:NaHSO4=== Na++H++SO,但NaHSO4属盐。
电解质溶液导电的原因1.电解质溶于水电离产生自由移动离子,自由移动离子在外加电场作用下定向移动形成电流。2.自由移动离子浓度越大,离子所带电荷数越多,溶液的导电性越强。
电解质溶液的导电原理电解质电离出的阴、阳离子在外加电场的作用下,发生定向移动实现导电过程,一般情况下,自由移动离子的浓度越大,所带的电荷数越多,电解质溶液的导电能力越强。(2)同一温度下,强电解质溶液(a)、弱电解质溶液(b)、金属导体(c)的导电能力相同,若升高温度,它们的导电能力大小顺序为b>a>c。
强电解质:在水溶液或熔化
强酸强碱大部分盐活泼金属氧化物
弱电解质:在水溶液或熔化 状态下部分电离
2、下列状态的物质,既能导电又属于电解质的是( ) A. MgCl2 晶体 B. NaCl 溶液 C. 液态氯化氢 D. 熔融 KOH
1.判断正误(正确的打“√”,错误的打“×”)。(1)电解质是自身可电离出离子的化合物。( )(2)单质和混合物既不是电解质,也不是非电解质。( )(3)在水中能导电的化合物一定是电解质。( )(4)纯水的导电性很差,但水是电解质。( )(5)氯化氢是电解质,但液态氯化氢不导电。( )
4.下列物质在水中的电离方程式正确的是( )A.K2SO4===2K++SOB.NaHSO4===Na++H++SOC.NaHCO3===Na++H++COD.BaCl2===Ba2++Cl-
3.物质M的水溶液能导电,是因为发生了如下电离:M===X2++2Y-,则下列判断正确的是( )A.M可能是酸 B.X2+一定是金属阳离子C.Y-一定是OH- D.M一定属于盐
5.现有以下物质:①氮气 ②液态CO2 ③氯化氢气体 ④铜片 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔融的KNO3 ⑨NaOH溶液,请回答下列问题(填序号):(1)以上物质能导电的是________。(2)以上物质中属于电解质的是________。(3)③⑧的电离方程式为③____________________________,⑧________________________________。
人教版 (2019)必修 第一册第二节 离子反应示范课ppt课件: 这是一份人教版 (2019)必修 第一册第二节 离子反应示范课ppt课件,共26页。PPT课件主要包含了导入一,导入二,离子反应,实验分析,离子方程式,课堂练习,CO32−,不可能,AgNO3,BaCl2等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应教课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应教课课件ppt,共23页。PPT课件主要包含了为什么,什么是复分解反应,不符合反应事实,不该拆的拆了,澄清石灰水应该拆,氧化物不该拆,电荷不守恒,漏了一些离子的反应等内容,欢迎下载使用。
人教版 (2019)必修 第一册第三节 氧化还原反应评课课件ppt: 这是一份人教版 (2019)必修 第一册第三节 氧化还原反应评课课件ppt,共21页。PPT课件主要包含了学习目标与核心素养,学习目标,核心素养,CuO,氧化反应,还原反应,课前导入,从化合价的角度,失去电子,电子对偏离的原子等内容,欢迎下载使用。













