

高考化学一轮复习考点精练之知识点17原电池含答案
展开这是一份高考化学一轮复习考点精练之知识点17原电池含答案,共14页。试卷主要包含了碱性电池具有容量大,锂—铜空气燃料电池容量高等内容,欢迎下载使用。
原电池
1、碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+2H2O(l)=Zn(OH)2(s)+2MnOOH(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极电极反应式为2MnO2(s)+2H2O(1)+2e-=2MnOOH(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
2、如图所示是几种常见的化学电源示意图,有关说法不正确的是( )
A.氢氧燃料电池的正极反应式为O2+4e-+2H2O=4OH-
B.干电池工作时,H+向石墨电极移动
C.铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g
D.上述电池分别属于一次电池、二次电池和燃料电池
3、如图是一种可充电锂一空气电池的示意图。当电池放电时,与在多孔碳材料电极处生成(x=0或1)下列说法正确的是( )
A.放电时,正极的电极反应式为
B.放电时,电池总反应为
C.充电时,电解质溶液中向多孔碳材料区迁移
D.充电时,多孔碳材料上发生还原反应
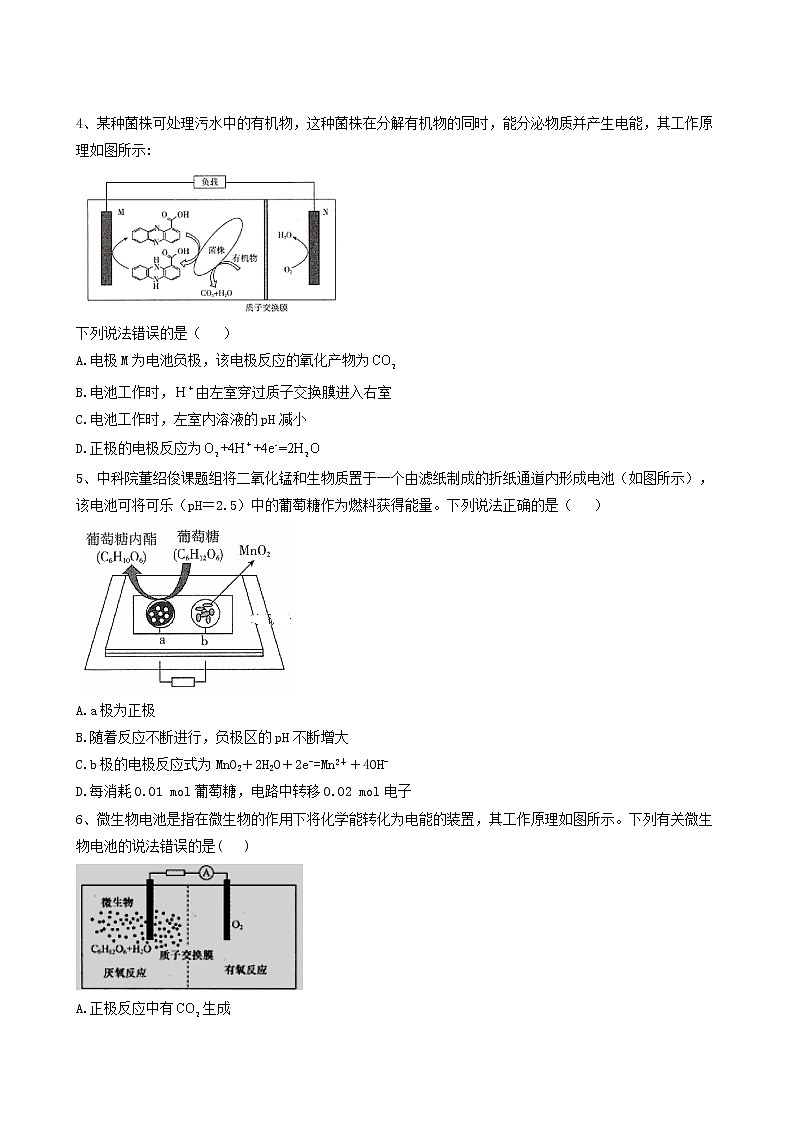
4、某种菌株可处理污水中的有机物,这种菌株在分解有机物的同时,能分泌物质并产生电能,其工作原理如图所示:
下列说法错误的是( )
A.电极M为电池负极,该电极反应的氧化产物为
B.电池工作时,由左室穿过质子交换膜进入右室
C.电池工作时,左室内溶液的pH减小
D.正极的电极反应为
5、中科院董绍俊课题组将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖作为燃料获得能量。下列说法正确的是( )
A.a极为正极
B.随着反应不断进行,负极区的pH不断增大
C.b极的电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D.每消耗0.01 mol葡萄糖,电路中转移0.02 mol电子
6、微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
A.正极反应中有生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从负极区移向正极区
D.电池总反应为
7、一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
A.反应,每消耗1 mol 转移12 mol 电子
B.电极A上参与的电极反应为
C.电池工作时,向电极B移动
D.电极B上发生的电极反应为
8、金属(M)-空气电池的工作原理如图所示。下列说法不正确的是( )
A.金属M作电池负极
B.电解质是熔融的MO
C.正极的电极反应式:
D.电池总反应式:
9、锂—铜空气燃料电池容量高、成本低,具有广阔的发展前景。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为,下列说法不正确的是( )
A.放电时,正极的电极反应式为
B.放电时,电子透过固体电解质向Li极移动
C.通空气时,铜电极被腐蚀,表面产生
D.整个反应过程中,氧化剂为
10、最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
A.右边吸附层中发生了还原反应
B.负极的电极反应式:
C.电池的总反应式:
D.电解质溶液中向右移动,向左移动
11、利用生物燃料电池原理研究室温下氨的合成,电池工作时在电极与酶之间传递电子,示意图如下所示。下列说法错误的是( )
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应
C.正极区,固氮酶为催化剂,发生还原反应生成
D.电池工作时质子通过交换膜由负极区向正极区移动
12、我国科学家研发了一种室温下“可呼吸”的Na-二次电池。将溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为。下列说法错误的是( )
A.放电时,向负极移动
B.充电时释放,放电时吸收
C.放电时,正极反应为
D.充电时,正极反应为
13、天然气催化重整反应为:。以该反应提供原料气,以熔融和为电解质的燃料电池的原理图如图所示。下列说法错误的是( )
A.该天然气的重整反应需在高温下才能自发进行
B.电流从空气极经导线流向“负载”
C.熔融电解质中移向空气极
D.该电池的正极反应:
14、一种用于驱动潜艇的液氨-液氧燃料电池原理示意如图,下列有关该电池说法正确的是( )
A.该电池工作时,每消耗22.4 L 转移3 mol电子
B.电子由电极A经外电路流向电极B
C.电池工作时,向电极B移动
D.电极B上发生的电极反应为
15、某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图甲)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
编号 | 试验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 |
② | 醋酸浓度的影响 | 0.5 |
| 36.0 |
③ |
| 0.2 | 2.0 | 90.0 |
(2)编号①实验测得容器中压强随时间变化如图乙。时,容器中压强明显小于起始压强,其原因是铁发生了_______________腐蚀,请在图丙中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了______________(填“氧化”或“还原")反应,其电极反应式是_____________。
(3)该小组对图乙中时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:______________________;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
16、某课外活动小组用如图装置进行实验,试回答下列问题:
1.若开始时开关K与a连接,则B极的电极反应为____________。
2.若开始时开关K与b连接,则B极的电极反应为___________,总反应的离子方程式为______________。
3.若开始时开关K与b连接.下列说法正确的是( )
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
4.该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应为________。此时通过阴离子交换膜的离子数 (填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因_________________________。
17、二氧化氯()是一种新型消毒剂,可用氯酸钠()为原料制备。
(1)隔膜电解法制备的装置示意图如下:
已知:在酸性溶液中比较稳定,在碱性溶液中不能稳定存在。
①产生的电极反应式:________。
②结合反应方程式,简述的产生过程:_________。
(2)过氧化氢还原法制备ClO2:
研究发现Cl-对上述反应有影响,实验记录如下:
加入NaCl 的浓/() | 的生成速率/() | 相同时间 | |||
10min | 30min | 60min | 产率/% | 的量 | |
0 | 0.0035 | 0.0124 | 0.0159 | 97.12 | 极微量 |
1.00 | 0.0138 | 0.0162 | 0.0163 | 98.79 | 极微量 |
①NaCl的主要作用是_______。
②上述反应可能的过程如下:
反应i:
反应ii:
将反应i填写完整。
③进一步研究发现,未添加Cl-时,体系中首先会发生反应生成,反应为:
(反应iii)。
分析反应i、ii、iii的速率大小关系并简要说明理由:_________。
(3)国家规定,饮用水中的残留量不得高于0.8,检测步骤如下:
Ⅰ.取1.0L的酸性水样,加入过量的碘化钾,再用氢氧化钠溶液调至中性,使
转化为。加入淀粉溶液,溶液变蓝。
Ⅱ.用0.0010mol/L溶液滴定步骤I中产生的。
已知:步骤II中发生反应的离子方程式是
①步骤I中发生的氧化还原反应的离子方程式是________。
②当步骤II中出现________(填现象)时,停止滴加溶液,记录其体积为10.00mL。
③上述水样中的残留浓度是______ 。
答案以及解析
1答案及解析:
答案:C
解析:A项,根据总反应可知Zn被氧化,为原电池的负极,正确;B项,根据电池总反应式为Zn(s)+2MnO2(s)+H2O(1)==Zn(OH)2(s)+Mn2O3(s),可知反应中MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq),正确;C项,原电池中,电子由负极经外电路流向正极,错误;D项,负极反应为Zn-2e-+2OH-=Zn(OH)2,外电路中每通过0.2 mol电子,消耗的Zn的物质的量为0.1 mol,质量为0.1 mol×65 g/mol=6.5 g,正确。
2答案及解析:
答案:C
解析:氢氧燃料电池的正极为氧气得电子,在碱性条件下生成OH-,A正确;干电池中石墨电极为正极,H+移动方向和电流方向相同,在电池内部向正极移动,B正确;铅蓄电池负极Pb失去电子同时结合硫酸根离子,生成PbSO4,负极质量增加,C不正确;铅蓄电池为二次电池,又称可逆电池或可充电电池,D正确。
3答案及解析:
答案:B
解析:A项,电池放电时,氧气在正极得电子发生还原反应,正极的电极反应式为,错误;B项,放电时,相当于Li和反应生成,电池总反应为,正确;C项,充电时,装置为电解池,阳极、阴极分别接电源正极和负极,Li作阴极,多孔碳作阳极,需得电子重新生成Li,所以电解质溶液中向阴极移动,即向锂电极区迁移,错误;D项,充电时,多孔碳作阳极,发生氧化反应,错误。
4答案及解析:
答案:A
解析:由原理图可知,电极M发生转化为的反应,即脱氢的氧化反应,故电极M为电池负极,电极反应为
2,氧化产物是,A项错误;为阳离子,在原电池中,阳离子从负极移向正极,B项正确;由负极的电极反应可知,左室内溶液pH减小,C项正确;正极为得电子生成水,其电极反应为,D项正确。
5答案及解析:
答案:D
解析:A项,a极上葡萄糖失电子生成葡萄糖内酯,a极为负极,A错误;B项,负极电极反应式为C6H12O6-2e-=C6H10O6+2H+,负极区生成H+,pH不断减小,B错误;C项,b极为正极,正极上MnO2得电子生成Mn2+,电极反应式为MnO2+4H++2e-=Mn2++2H2O,C错误;D项,由负极电极反应式可知,每消耗1 mol葡萄糖电路中转移2 mol电子,D正确。
6答案及解析:
答案:A
解析:A项,正极是得电子发生还原反应与结合生成,无生成,错误;C项,原电池中阳离子()移向正极,正确;D项,电池总反应是与发生的反应,正确。
7答案及解析:
答案:D
解析:A项,中的C为–4价,反应后生成的CO中C为+2价,消耗1 mol 转移6 mol ,错误;B项,从装置图中看,电解质离子中没有,错误;C项,该燃料电池中,电极B为正极,通入CO和的一极为负极,原电池中移向负极即A极,错误;D项,从电极B处知,和结合,转化为,正确。
8答案及解析:
答案:B
解析:金属(M)-空气电池中M失电子作负极,故A正确;根据传递和,可知电解质是熔融的,故B错误;空气中的氧气得电子作正极,电极反应式为,故C正确;电池总反应式为,故D正确。
9答案及解析:
答案:B
解析:A.放电过程为,正极上反应,碱性条件下通空气时,铜被氧化表面产生,故A、C正确;B.放电时,阳离子向正极移动,则透过固体电解质向Cu极移动,但电子不能在电解质中流动,故B错误;D.通空气时,铜被腐蚀,表面产生,放电时转化为Cu,则整个反应过程中氧化剂为,故D正确。
10答案及解析:
答案:C
解析:右边吸附层中生成是正极,发生了还原反应,A正确;左边吸附层是负极发生,B正确,电池放电的过程中,没有氧气参与反应,C错误;电解质溶液中向右(正极)移动,向左(负极)移动,D正确。
11答案及解析:
答案:B
解析:相比现有工业合成氨,该方法选用酶作催化剂,条件温和,同时利用和的相互转化,化学能转化为电能,故可提供电能,故A正确;左室为负极区,在负极失电子发生氧化反应生成,电极反应式为,放电生成的在氢化酶的作用下与反应生成和,反应的方程式为,故B错误;右室为正极区, 正极得电子发生还原反应生成,电极反应式为,放电生成的与在固氮酶的作用下反应生成和,故C正确;电池工作时,氢离子(即质子)通过交换膜由负极向正极移动,故D正确。
12答案及解析:
答案:D
解析:放电时为原电池,而溶液中的阴离子移向电池的负极.故A项正确;由题干中的信息可以得出Na为电池的负极材料,因电池的总反应为,则电池放电时吸收,充电时放出,故B项正确;放电时在正极放电,而充电时会在正极生成,Na在电池的负极参与反应,在充电时又会在电池的负极生成,故C项正确,D项错误。
13答案及解析:
答案:C
解析:该催化重整反应为吸热反应,且为熵增反应,故高温下才可以自发进行,A项正确;由燃料极的反应可知,燃料极为电池负极,空气极为电池正极,电流由正极流出,B项正确;原电池中电解质中的阴离子移向电池负极,即移向燃料极,C项错误;空气极为电池正极,参与该电极反应,正极反应为,D项正确。
14答案及解析:
答案:B
解析:A. 燃料电池的总反应是燃料燃烧的化学方程式:,该电池工作时,每消耗标准状况下的22.4L即1mol 转移3mol电子,故A错误; B. 电子从负极流向正极,即从电极A流向电极B,故B正确; C. 原电池中,阴离子向负极移动,则OH−向负极A移动,故C错误; D. 碱性条件下,氧气在正极生成氢氧根离子,其电极反应为:,故D错误; 故选B。
15答案及解析:
答案:(1)
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
② |
|
| 2.0 |
|
③ | 碳粉含量的影响 |
|
|
|
(2)吸氧(如图);还原;(或);
(3)反应放热,温度升高
(4)
解析:(1)对比实验要求只有一个条件不同,其他条件都要相同,则②是探究醋酸浓度的影响,则铁粉的质量必须为2.0 g;③和①相比,为碳粉质量不同。
(2)酸性条件下发生析氢腐蚀,所以一开始压强增大,当酸的量减少,铁发生吸氧腐蚀,导致压强减小;铁作为负极,失去电子,碳作正极,碳粉表面是氧气发生还原反应,电解质溶液依然显弱酸性,则电极反应式为。
(3)反应放热也能导致压强增大。
(4)排除吸氧腐蚀的方法为将反应装置中的氧气排出,再滴入醋酸,若压强增大,则假设一正确。
16答案及解析:
答案:
(1)Fe-2e- = Fe2+;
(2)2H++2e- = H2↑ ; 2Cl-+2H2O 2OH-+ H2↑+ Cl2↑ ; 氯碱工业
(3) BD
(4)
①4OH--4e- =2H2O+O2↑; 小于
②D
③电解过程中阴极区是水电离出的氢离子放电,2H++2e-=H2↑,所以水的电离平衡正向移动,导致氢氧根离子浓度大于氢离子,溶液显示碱性.
解析:
(1)开始时开关K与a连接形成原电池反应,B电极铁做负极失电子生成亚铁离子,电极反应为:Fe-2e-=Fe2+,故答案为:Fe-2e-=Fe2+;
(2)开关K与b连接,装置为电解池,铁为阴极,发生还原反应,氢离子得到电子生成氢气,即B电极反应为2H++2e-=H2↑;电解饱和食盐水生成氢氧化钠、氢气和氯气,电解总反应的离子方程式为2Cl-+2H2O2OH-+H2↑+Cl2↑,
故答案为:2H++2e-=H2↑;2Cl-+2H2O2OH-+H2↑+Cl2↑;
(3)A、电解过程中阳离子向阴极移动,B为阴极,溶液中Na+向B极移动,故A错误;
B、A生成氯气,能使湿润KI淀粉试纸变蓝,故B正确;
C、反应一段时间后加适量HCl气体,可恢复到电解前电解质的浓度,不是加入盐酸,故C错误;
D、若标准状况下B极产生2.24L氢气,为氢气物质的量为0.1mol,依据电极反应计算,由2H++2e-=H2↑得到溶液中转移0.2mol电子,故D正确;
故答案为:BD;
(4)①电解时,阳极上失电子发生氧化反应,溶液中的氢氧根离子的放电能力大于硫酸根离子的放电能力,所以阳极上氢氧根离子失电子生成水和氧气4OH--4e-=2H2O+O2↑;阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数.
故答案为:4OH--4e-=2H2O+O2↑;小于;
②电解产生的氢氧化钾在阴极生成,所以氢氧化钾溶液从出口D流出,故答案为:D;
③电解过程中阴极区是水电离出的氢离子放电,2H++2e-=H2↑,所以水的电离平衡正向移动,导致氢氧根离子浓度大于氢离子,溶液显示碱性,故答案为:电解过程中阴极区是水电离出的氢离子放电,2H++2e-=H2↑,所以水的电离平衡正向移动,导致氢氧根离子浓度大于氢离子,溶液显示碱性.
17答案及解析:
答案:①
②阴极反应:,产生的在溶液中与发生反应:
。一部分逸出,一部分循环反应
(2)①催化剂
②
③反应i较快,反应ii与反应i速率相当或更快,反应iii较慢。
因为产率很高并且的量极微量,并且不添加时起始生成的速率很慢
(3)①
②溶液蓝色恰好消失,30s内不变为蓝色
③0.675
解析:
相关试卷
这是一份高考化学一轮复习考点精练之知识点25有机化学基础含答案,共15页。试卷主要包含了下列涉及有机物的说法中正确的是,下列关于有机物的说法正确的是,下列表述正确的是,下列对合成材料的认识不正确的是,下列说法错误的是等内容,欢迎下载使用。
这是一份高考化学一轮复习考点精练之知识点22化学实验基础含答案,共11页。试卷主要包含了下列试剂的保存方法正确的是,下列去除杂质,下列除去杂质的方法正确的是,下列实验不能达到目的的是,下列实验基本操作正确的是等内容,欢迎下载使用。
这是一份高考化学一轮复习考点精练之知识点16盐类水解含答案,共13页。试卷主要包含了实验测得0.5 溶液,下列说法正确的是等内容,欢迎下载使用。












