

2022届北京市昌平区高三二模化学试题含解析
展开
这是一份2022届北京市昌平区高三二模化学试题含解析,共29页。试卷主要包含了单选题,综合题等内容,欢迎下载使用。
北京市昌平区2022届高三二模
化学试题
一、单选题
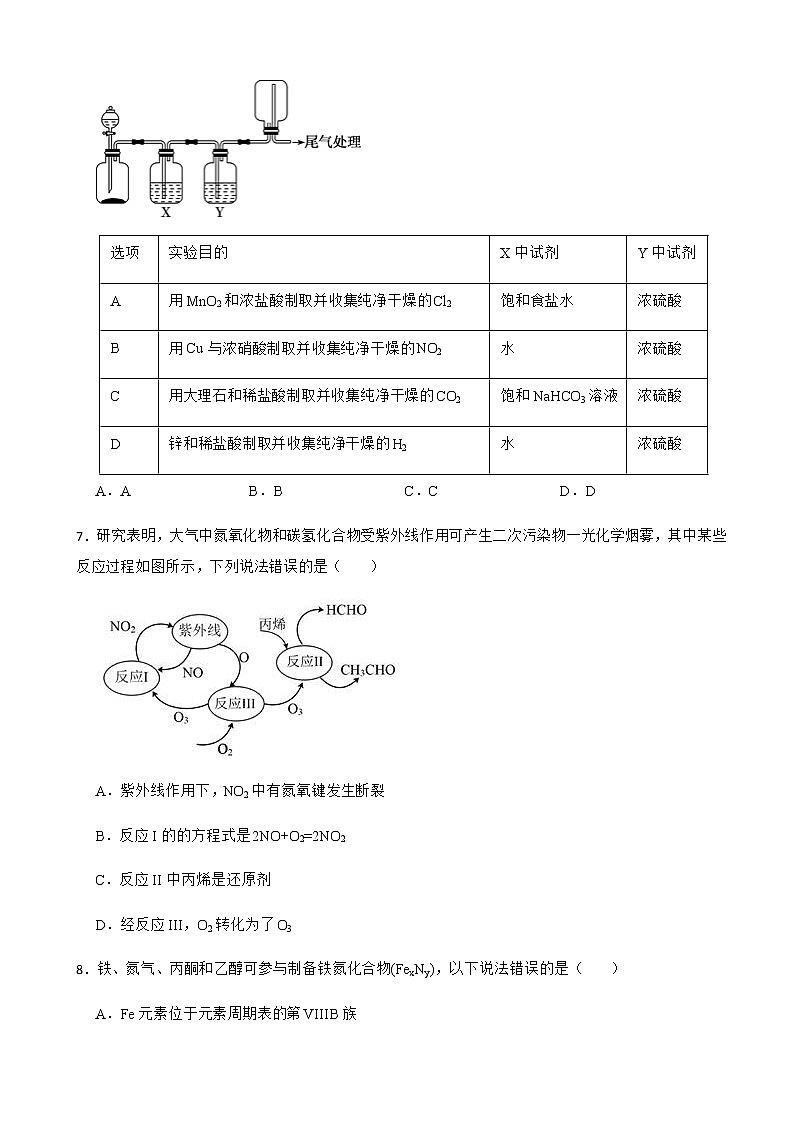
1.化学与生活密切相关,下列过程与氧化还原反应有关的是( )
A.图甲碳酸氢钠片可治疗胃酸过多
B.图乙豆浆中加入浓盐溶液,产生沉淀
C.图丙天然气燃烧
D.图丁海水经风吹日晒获得粗盐
2.下列有关化学用语表述正确的是( )
A.中子数为16的硫原子: 1632 S
B.还原性:NaFe2+,实验ii中I-H2X>HX- ,根据强酸制弱酸的原则,HY与少量Na2X发生的反应是:2HY+X2-=H2X+2Y-,故D不符合题意;
故答案为:C。
【分析】A.溶液中存在电离平衡,H2X为弱酸;
B.碱滴入酸溶液中,先生成HX﹣,当前部转化为HX﹣,继续滴加氢氧化钠溶液,反应生成X2﹣;
C.a点为H2X和NaHX,b点为NaHX和Na2X的混合溶液,酸抑制水的电离,含弱酸根的盐水解促进水的电离;
D.图中a点c(H2X)=c(HX﹣),pH=7,计算H2X的第一步电离平衡常数,与Ka(HY)比较判断酸性强弱,再书写反应的方程式。
13.【答案】D
【解析】【解答】A.DNA由两条脱氧核苷酸链构成,脱氧核糖核苷酸链由多个脱氧核糖核苷酸分子通过分子间脱水形成磷酯键后聚合而成,A不符合题意;
B.图中框内的结构可以看成是由脱氧核糖分子与H3PO4分子、碱基分子通过分子间脱水连接而成的,B不符合题意;
C.如图所示,胸腺嘧啶中含有酰胺基官能团(-CO-NH-);C不符合题意;
D.如图所示,DNA分子的四种碱基均含N-H键,一个碱基中的N-H键的H原子能与另一个碱基中的N、O原子形成氢键,D符合题意;
故答案为:D。
【分析】A.脱氧核苷酸分子间脱水形成磷酯键后聚合成DNA;
B.图中框内的结构可以看成是由脱氧核糖分子中的羟基与H3PO4分子、碱基分子通分子间脱水得到;
C.该分子中存在-CONH-;
D.一个碱基中的N-H键的H原子能与另一个碱基中的O原子形成氢键。
14.【答案】B
【解析】【解答】A.i中生成黄色沉淀是碘化银沉淀,反应是:Ag++I-=AgI↓,故A不符合题意;
B.可依据i中现象推测,溶液中存在I-,因为Fe3+也呈黄色,不能推测实验I中的棕黄色主要是I2引起的,故B符合题意;
C.对照实验ii、iii,可推测ii中增大c(Fe2+),导致Fe2+还原性大于I-,平衡向左移动,I2浓度降低导致颜色变浅,故C不符合题意;
D.实验i现象说明平衡正向移动,则还原性:实验i中I->Fe2+,实验ii中实验现象说明平衡逆向移动,说明还原性:I-Fe2+,实验ii还原性:I-N>C>H
(2)sp3
(3)Cu2+
(4)6;c(OH-)增大,发生反应Cu2++2OH-=Cu(OH)2↓,使螯合反应向逆反应方向进行,c(Q)减小,因此吸附能力下降;酸性较强时,氮原子与氢原子具有较强的配位能力,N原子与Cu2+配位减小,c(Q)减小,因此吸附能力下降
【解析】【解答】(1)M中四种元素分别为H、C、N、O,由元素性质周期性变化规律知,元素非金属性越强,电负性越强,则电负性由大到小的顺序为 O>N>C>H ,故答案为: O>N>C>H ;
(2)M中N原子的价电子对数为 3+5-3×12=4 ,则杂化轨道类型为sp3,故答案为:sp3;
(3)Q中存在配位键,其中提供空轨道的是Cu2+,故答案为:Cu2+;
(4)①由图示知,其中pH约为6时吸附效果最好,故答案为:6;
②根据平衡移动原理分析,c(OH-)增大,发生反应Cu2++2OH-=Cu(OH)2↓,使螯合反应向逆反应方向进行,c(Q)减小,因此吸附能力下降,故答案为:c(OH-)增大,发生反应Cu2++2OH-=Cu(OH)2↓,使螯合反应向逆反应方向进行,c(Q)减小,因此吸附能力下降;
③从结构角度分析,酸性较强时,氮原子与氢原子具有较强的配位能力,N原子与Cu2+配位减小,c(Q)减小,因此吸附能力下降,故答案为:酸性较强时,氮原子与氢原子具有较强的配位能力,N原子与Cu2+配位减小,c(Q)减小,因此吸附能力下降。
【分析】(1)元素的非金属性越强,电负性越大;
(2)M中N原子形成三个σ键,含有一个孤电子对;
(3)Q中铜离子和O原子形成配位键, Cu2+提供空轨道;
(4)①pH为6时吸附效果最好;
②碱性过强,铜离子转化为氢氧化铜沉淀;
③酸性较强时,N原子与Cu2+配位减小,c(Q)减小。
17.【答案】(1)过滤;萃取分液
(2)将废液中的 Fe2+ 氧化为 Fe3+
(3)Ca2++2F-=CaF2↓ , Mg2++2F-=MgF2↓;3×10-2
(4)Ni2+、Zn2+、F-、Cl-、 SO42-
(5)萃取产生H+,随pH的升高H+被消耗,促进萃取金属离子的反应正向移动
(6)Ca(OH)2+Ni2++SO42-=Ni(OH)2↓+CaSO4↓
【解析】【解答】(1)操作1、2用于分离沉淀和溶液,故名称是过滤,操作3的名称是萃取分液。
(2)操作1中加入Cl2的主要目的是将废液中的 Fe2+ 氧化为 Fe3+ 。
(3)NiF2溶液使Ca2+、Mg2+转化为CaF2、MgF2沉淀,参与反应的离子方程式是 Ca2++2F-=CaF2↓ , Mg2++2F-=MgF2↓ 。已知,25℃时,Ksp(CaF2)=4×10-11,Ksp(MgF2)=9×10-9,则CaF2溶解度小于MgF2,钙离子先沉淀,镁离子后沉淀,已知(c(杂质离子)≤10-5mol/L即可视为沉淀完全,则杂质离子沉淀完全时,溶液中c(F-) =Ksp(MgF2)c(Mg2+)=9×10-91×10-5=3×10-2 mol/L。
(4)结合流程与分析,滤液b中含有的微粒主要有Ni2+、Zn2+、F-、Cl-、 SO42- 离子。
(5)P204(二乙基己基磷酸)萃取金属离子的反应为:x +Mx+⇌ M+xH+,萃取产生H+,随pH的升高H+被消耗,促进平衡正向移动,故P204对某些金属离子的萃取率随pH的升高而升高。
(6)母液中含有Ni2+、加入强碱Ca(OH)2,可得到Ni(OH)2,多余钙离子可转化为硫酸钙沉淀在操作1中被过滤与氢氧化铁一起除去,故加入石灰乳可制备操作1中所需Ni(OH)2浆液,离子方程式 Ca(OH)2+Ni2++SO42-=Ni(OH)2↓+CaSO4↓ 。
【分析】酸性硫酸镍废液(含有Fe2+、Zn2+、Mg2+、Ca2+等杂质离子),加入Cl2氧化Fe2+,用Ni(OH)2调节溶液pH值,使Fe3+转化为氢氧化铁沉淀除去,再进行过滤,得滤渣为Fe(OH)3;得到滤液a含有Ni2+、Zn2+、Mg2+、Ca2+等离子,向滤液a加入NaF溶液,使Ca2+、Mg2+转化为CaF2、MgF2沉淀,再次进行过滤得到滤液b含有Ni2+、Zn2+等离子,加入萃取剂萃取Zn2+,有机相中含有锌,通过反萃取使萃取剂再生;萃余液含有Ni2+和硫酸根离子等,进行蒸发浓缩、降温结晶、过滤洗涤等操作得到产品硫酸镍晶体,母液中加碱溶液得到Ni(OH)2可循环利用;
(1)操作1、2为过滤,操作3为分液;
(2)加入Cl2将Fe2+氧化为Fe3+;
(3)加入NaF溶液,使Ca2+、Mg2+转化为CaF2、MgF2沉淀;根据,Ksp(CaF2)=4×10-11,Ksp(MgF2)=9×10-9计算;
(4)滤液b含有 Ni2+、Zn2+、F-、Cl-、 SO42- ;
(5)pH升高,氢离子浓度减小,有利于反应正向进行;
(6)母液主要含有氯化镍,加入澄清石灰水得到Ni(OH)2。
18.【答案】(1)3
(2)+90.41
(3)增大;该反应为吸热反应,升高温度,平衡正向进行,n(H2)增大
(4)R1、R2均为吸热反应,随着温度升高,平衡正向移动,n(H2)增大,同时R4为放热反应,随着温度升高,平衡逆向进行,n(H2)也增大,R3为放热反应,随着温度的升高,平衡逆向进行,n(H2)减小,R1、R2、R4影响大于R3
(5)升高温度;增加水碳比
(6)b;6 NH2- -6e-=N2↑+4NH3;2
【解析】【解答】(1)根据甲醇蒸汽重整反应:CH3OH(g)+H2O(g) ⇌ CO2(g)+3H2(g)可知,每产生3mol氢气消耗1mol甲醇,则产氢率= 产生的氢气的物质的量消耗的甲醇的物质的量=3mol1mol=3 ;
(2)根据已知信息,R1=R2+R3,由盖斯定律可得,△H2=△H1-△H3=(+49.24kJ/mol)-(-41.17kJ/mol)=+90.41kJ/mol;
(3)已知R1:CH3OH(g)+H2O(g) ⇌ CO2(g)+3H2(g) △H1=+49.24kJ/mol,该反应为吸热反应,升高温度,平衡正向进行,n(H2)增大;
(4)由反应可知,R1、R2均为吸热反应,随着温度升高,平衡正向移动,n(H2)增大,同时R4(积碳反应)前两步为放热反应,随着温度升高,平衡逆向进行,n(H2)也增大,R3为放热反应,随着温度的升高,平衡逆向进行,n(H2)减小,R1、R2、R4影响大于R3,因此在600-912K时,随着温度升高,氢气的摩尔分数增大;
(5)若要减少积碳,需使反应R4逆向进行,由于R4为放热反应,故可采取升高温度的方式使反应逆向进行,减少积碳;也可以增大水碳比,使H2O的物质的量增大,平衡逆向进行,积碳减少;
(6)①由装置可知,a连电池的正极,为阳极,失去电子发生氧化反应,b连电池的负极,为阴极,得到电子发生还原反应,故发生的电极反应为6NH3+6e-=3H2↑+6NH 2- 的电极是阴极,即电极b;
②a为阳极, NH2- 失去电子发生氧化反应,电极反应式为6 NH2- -6e-=N2↑+4NH3;
③由阴极反应式6NH3+6e-=3H2↑+6NH 2- 可知,2e-~H2,则利用该装置产生1mol氢气时,转移电子的物质的量是2mol。
【分析】(1)根据产氢率的公式计算;
(2)根据盖斯定律计算;
(3)该反应为吸热反应,升高温度,平衡正向进行;
(4)R1、R2均为吸热反应,随着温度升高,平衡正向移动,n(H2)增大,同时R4(积碳反应)前两步为放热反应,随着温度升高,平衡逆向进行,n(H2)也增大,R3为放热反应,随着温度的升高,平衡逆向进行;
(5)若要减少积碳,需使反应R4逆向进行;
(6)①a连电池的正极,为阳极,失去电子发生氧化反应,b连电池的负极,为阴极,得到电子发生还原反应;
②a极上NH2-失去电子发生氧化反应;
③结合电极反应计算。
19.【答案】(1)ClO-+Cl-+2H+=Cl2↑+H2O;ClO-+H2O⇌HClO+OH-
(2)将带火星的木条伸入烧杯中,木条复燃
(3)b;Ca2++ClO-+2Cu2++6OH-=Ca(CuO2)2↓+Cl-+3H2O
(4)Fe2++ClO-+4OH-=FeO42-+2Cl-+2H2O
【解析】【解答】(1)次氯酸跟与氯离子反应生成氯气,离子反应方程式为: ClO-+Cl-+2H+=Cl2↑+H2O ;次氯酸钙溶液显碱性是由于次氯酸跟的水解,离子反应方程式为: ClO-+H2O⇌HClO+OH- ;
(2)若产生的气体为氧气,可使带火星的木条复燃,故实验操作为:将带火星的木条伸入烧杯中,木条复燃;
(3)预测悬浊液成分为CuO,加稀硫酸后有气体产生,同时还有蓝色溶液生成,故悬浊液成分不一定是CuO,但也不能确定悬浊液中是否有CuO存在,
故答案为:b;
(4)实验1中i的反应为生成Ca(CuO2)2的反应,离子反应方程式为: Ca2++ClO-+2Cu2++6OH-=Ca(CuO2)2↓+Cl-+3H2O ;根据题干信息,某些低价金属化合物在碱性条件下能被某些强氧化剂氧化为高价酸根离子,故亚铁离子在碱性条件下被次氯酸钠氧化成高铁酸根,加KOH后生成高铁酸钾。第一步的离子反应方程式为: Fe2++ClO-+4OH-=FeO42-+2Cl-+2H2O 。
【分析】(1)ClO-与Cl﹣在酸性条件下反应生成Cl2,Ca( ClO)2溶液中次氯酸根离子水解显碱性;
(2)氧气可以使带火星的木条复燃;
(3)①氧化亚铜与稀硫酸发生反应Cu2O+H2SO4=CuSO4+Cu+H2O,Cu不溶于水;
②悬浊液中有高铜酸钙:Ca(CuO2)2, 说明生成了Ca(CuO2)2和氯气;
(4)第一步反应为氯化亚铁在碱性条件下被氧化为高铁酸钠。
相关试卷
这是一份北京市房山区2022-2023学年高三二模化学试题(含解析),共23页。试卷主要包含了单选题,结构与性质,工业流程题,有机推断题,原理综合题,实验题等内容,欢迎下载使用。
这是一份2023年北京昌平区高三二模化学试题及答案,共13页。
这是一份2022届北京市昌平区高三二模化学试题PDF版含答案,共14页。









