化学九年级上册第1节 金属的性质和利用教案
展开5.1金属的性质和利用
教学目标
【知识与能力】
1.了解金属的物理性质,能区分常见的金属和非金属。
2.知道常见金属与氧气、酸的反应,铁与硫酸铜之间的反应,置换反应的概念。
3.掌握实验室制备氢气的原理和操作。
4.知道合金的概念,了解合金具有的性质及合金与纯金属的异同。
【过程与方法】
1.通过对金属性质的实验探究,学习利用实验认识物质的性质和变化的方法。
2.通过探究实验,进一步认识和体验科学探究的过程。
【情感态度价值观】
1.加深对物质的性质决定其用途的观点的认识。
2.通过对钢铁、青铜等合金知识的了解,认识金属材料在生产、生活和社会发展中的重要作用,培养学生的爱国主义情感。
教学重难点
【教学重点】
1.金属的物理性质和化学性质。
2.理解置换反应的概念,并了解该类反应的特点。
【教学难点】
金属的化学性质。
课前准备
仪器:水槽、试管、镊子、烧杯、砂纸、酒精灯、导气管等。
药品:铜片、铁片、铁钉、稀硫酸、稀盐酸、锌粒、水等。
教学过程
【情景引入】在人类社会发展的历史上,曾经以青铜、铁器作为历史时代的标志。可见,金属是一类重要的材料,人类的生活和生产都离不开金属。今天,我们探究的第一个问题就是金属的物理性质。
【教师引导】请同学们以小组为单位讨论并举出一些生活中常见或常用的金属制品,想一想它们各是用什么金属制成的?分别利用了该金属的哪些物理性质?并将讨论结果记录在P114表5-2中。
答案要点:
金属的应用 | 金属具有的物理性质 |
金属纽扣、金箔画、金银首饰 | 有金属光泽 |
钢筋、桥梁支架 | 机械强度大 |
铜导线 | 优良的导电性 |
铁锅 | 优良的导热性 |
金箔、铝箔 | 延展性好 |
灯泡中的钨丝 | 熔点高 |
【联想与启示】
1.为什么铁制锅铲需要加上木柄或塑料柄?
2.银的导电性比铜好,一般情况下为什么不用银制造电线、电缆?
3.选择铸造硬币的金属材料需要考虑哪些因素?
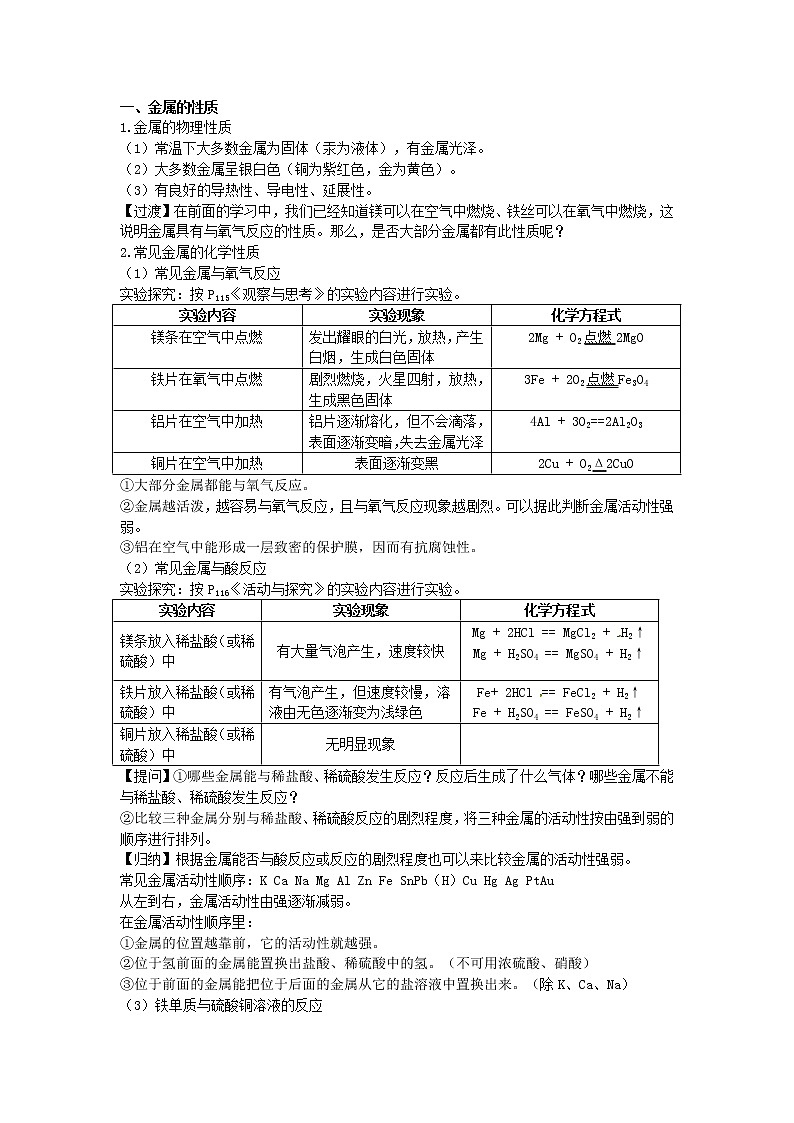
一、金属的性质
1.金属的物理性质
(1)常温下大多数金属为固体(汞为液体),有金属光泽。
(2)大多数金属呈银白色(铜为紫红色,金为黄色)。
(3)有良好的导热性、导电性、延展性。
【过渡】在前面的学习中,我们已经知道镁可以在空气中燃烧、铁丝可以在氧气中燃烧,这说明金属具有与氧气反应的性质。那么,是否大部分金属都有此性质呢?
2.常见金属的化学性质
(1)常见金属与氧气反应
实验探究:按P115《观察与思考》的实验内容进行实验。
实验内容 | 实验现象 | 化学方程式 |
镁条在空气中点燃 | 发出耀眼的白光,放热,产生白烟,生成白色固体 | 2Mg + O2点燃2MgO |
铁片在氧气中点燃 | 剧烈燃烧,火星四射,放热,生成黑色固体 | 3Fe + 2O2点燃Fe3O4 |
铝片在空气中加热 | 铝片逐渐熔化,但不会滴落,表面逐渐变暗,失去金属光泽 | 4Al + 3O2==2Al2O3 |
铜片在空气中加热 | 表面逐渐变黑 | 2Cu + O2Δ2CuO |
①大部分金属都能与氧气反应。
②金属越活泼,越容易与氧气反应,且与氧气反应现象越剧烈。可以据此判断金属活动性强弱。
③铝在空气中能形成一层致密的保护膜,因而有抗腐蚀性。
(2)常见金属与酸反应
实验探究:按P116《活动与探究》的实验内容进行实验。
实验内容 | 实验现象 | 化学方程式 |
镁条放入稀盐酸(或稀硫酸)中 | 有大量气泡产生,速度较快 | Mg + 2HCl == MgCl2 + H2↑ Mg + H2SO4 == MgSO4 + H2↑ |
铁片放入稀盐酸(或稀硫酸)中 | 有气泡产生,但速度较慢,溶液由无色逐渐变为浅绿色 | Fe+ 2HCl == FeCl2 + H2↑ Fe + H2SO4 == FeSO4 + H2↑ |
铜片放入稀盐酸(或稀硫酸)中 | 无明显现象 |
|
【提问】①哪些金属能与稀盐酸、稀硫酸发生反应?反应后生成了什么气体?哪些金属不能与稀盐酸、稀硫酸发生反应?
②比较三种金属分别与稀盐酸、稀硫酸反应的剧烈程度,将三种金属的活动性按由强到弱的顺序进行排列。
【归纳】根据金属能否与酸反应或反应的剧烈程度也可以来比较金属的活动性强弱。
常见金属活动性顺序:K Ca Na Mg Al Zn Fe SnPb(H)Cu Hg Ag PtAu
从左到右,金属活动性由强逐渐减弱。
在金属活动性顺序里:
①金属的位置越靠前,它的活动性就越强。
②位于氢前面的金属能置换出盐酸、稀硫酸中的氢。(不可用浓硫酸、硝酸)
③位于前面的金属能把位于后面的金属从它的盐溶液中置换出来。(除K、Ca、Na)
(3)铁单质与硫酸铜溶液的反应
实验现象:铁钉表面覆盖一层光亮的红色固体,溶液由蓝色逐渐变为浅绿色。
化学方程式:Fe +CuSO4 == FeSO4 + Cu
二、置换反应
1.概念
由一种单质跟一种化合物作用生成另一种单质和另一种化合物的反应叫做置换反应。
2.置换反应是四大基本反应类型中的一种。
3.可利用置换反应比较金属活动性的强弱。
【过渡】我们已经知道镁、铝、铁等金属都能与稀盐酸(或稀硫酸)发生置换反应生成氢气,那么在实验室中又是如何制备氢气的呢?
三、实验室制取氢气
实验室常用锌与稀盐酸(或稀硫酸)发生置换反应制取氢气。氢气的密度比空气小,可用向下排空气法收集;又由于氢气难溶于水,也可用排水法收集。
反应原理 | Zn+ H2SO4 = ZnSO4 + H2↑ Zn+ 2HCl = ZnCl2 + H2↑ |
实验装置 | |
实验步骤 | 1.组装仪器,检查装置的气密性;2.加锌粒;3.注入稀硫酸(或稀盐酸); 4.验纯;5.收集氢气 |
【过渡】金属是生活、生产中应用非常广泛的一类材料。金属材料具有各种特殊性能,因而具有广泛的用途。纯金属很难满足各种特殊要求。因此,人们在生产实践中制造出了许多具有特殊性能的“新型金属”——合金。
四、合金
1.概念
合金是由一种金属跟其他金属(或非金属)熔合形成的有金属特性的物质。
2.特点
(1)合金具有许多良好的物理、化学和机械性能。
(2)合金的硬度一般比各成分金属大。
(3)多数合金的熔点低于组成它的成分金属。
3.常见合金列表
合金 | 铁的合金 | 铜合金 | 焊锡 | 钛合金 | 形状记忆合金 | ||
生铁 | 钢 | 黄铜 | 青铜 | ||||
成分 | 含碳量 2%~4.3% | 含碳量 0.03%~2% | 铜锌 合金 | 铜锡 合金 | 铅锡 合金 | 钛+其他元素 | 镍钛合金 |
备注 | 不锈钢:含铬、镍的钢, 具有抗腐蚀性能 | 紫铜为纯铜 | 熔点低 |
|
| ||
注:钛合金被认为是21世纪的重要金属材料,钛合金与人体有很好的“相容性”,因此可用来制造人造骨等。钛合金具有如下优点:(1)熔点高、密度小;(2)可塑性好、易于加工、机械性能好;(3)抗腐蚀性能好。
五、板书
(一)金属的性质
1.金属的物理性质
2.常见金属的化学性质
(1)常见金属与氧气反应
(2)常见金属与酸反应
(3)铁单质与硫酸铜溶液的反应
(二)置换反应
(三)实验室制取氢气
(四)合金
六、课堂练习
1.常见金属的下列用途各利用了金属的哪些性质?
(1)用铁锅炒菜_________________________________________________________。
(2)将铜打磨成铜镜_____________________________________________________。
(3)将铝拉成丝作电线___________________________________________________。
(4)用铁做刀、矛等武器_________________________________________________。
(5)人们用黄金做项链、耳环、戒指_______________________________________。
2.下列说法中正确的是()
A.多数合金的熔点等于组成它的金属熔点的平均值
B.在金属中添加非金属或金属元素可以改良原有金属的特性
C.“湿法冶金”在我国殷商时期就已出现
D.金属材料就是各种金属
3.铁丝放入硫酸铜溶液中,下列描述中不正确的是()
A.铁丝表面有红色金属铜生成 B.溶液颜色由蓝色逐渐变为浅绿色
C.溶液质量增加 D.铁丝中铁的质量逐渐减少
4.下列反应中,属于置换反应的是()
A.2H2O2==2H2O+ O2↑ B.CuO+CO==Cu+CO2
C.H2+CuO==Cu+H2O D.CO2+H2O==H2CO3
5.武德合金(用50%铋、25%铅、12.5%锡和12.5%镉制成的,它的熔点是70 ℃)常用于电器保险丝是因为它具有下列性质中的()
①熔点低②能导电③延展性能好④不易氧化⑤硬度大
A.① B.①②③④ C.①③D.全部
6.下列做法符合科学常识的是()
A.电路中的保险丝熔断后,换用了更粗的保险丝
B.向燃着的酒精灯中添加酒精
C.用燃着的木条检验石油液化气是否泄漏
D.油罐车的尾部装有一条拖在地面上的铁链
初中化学第1节 金属的性质和利用教案: 这是一份初中化学第1节 金属的性质和利用教案,共2页。
沪教版九年级上册第2节 金属矿物 铁的冶炼教学设计: 这是一份沪教版九年级上册第2节 金属矿物 铁的冶炼教学设计,共4页。教案主要包含了知识与能力,过程与方法,情感态度价值观,教学重点,教学难点,情景引入,交流讨论,教师引导等内容,欢迎下载使用。
初中化学沪教版九年级上册第3节 金属防护和废金属回收教案: 这是一份初中化学沪教版九年级上册第3节 金属防护和废金属回收教案,共4页。教案主要包含了知识与能力,过程与方法,情感态度价值观,教学重点,教学难点,情景引入,教师引导,实验探究等内容,欢迎下载使用。