




鲁科版 (2019)必修 第二册第1节 原子结构与元素性质教学演示ppt课件
展开【思考】多个电子的原子里,电子是怎样运动的呢?
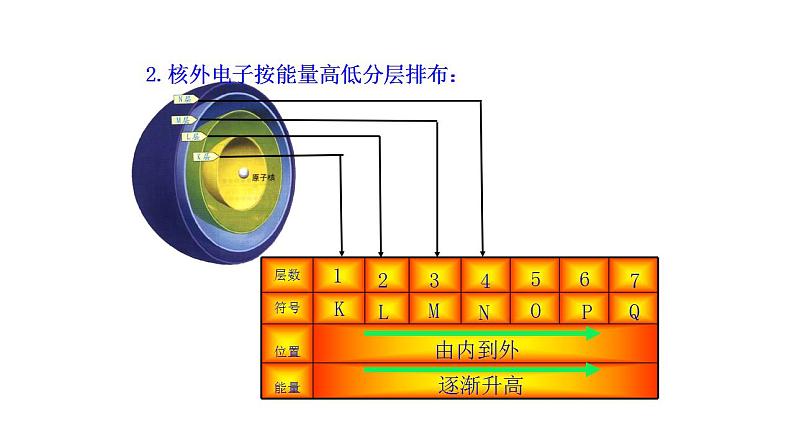
提示:电子按能量高低在核外分层排布。
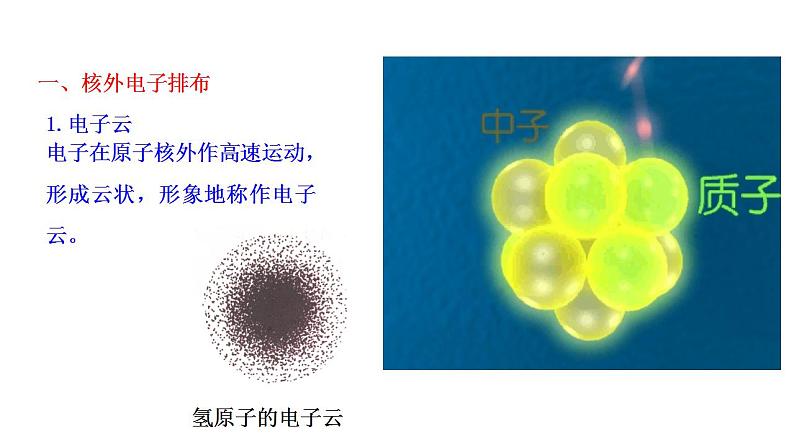
我们已经知道,原子是由原子核和核外电子构成的。电子围绕着核作高速运动。氢原子核外只有一个电子,电子的运动比较简单。
1.了解原子核外电子分层排布的规律。2.初步学习原子结构与元素性质的关系。
1.能根据原子结构特征确定元素。(宏观辨识与微观探析)2.具有证据意识,能基于证据对物质组成、结构及其变化提出可能的假设,通过分析推理加以证实或证伪。(证据推理与模型认知)
电子在原子核外作高速运动,形成云状,形象地称作电子云。
多电子的原子里,所有电子都在原子核外的同一个空间运动吗?原子核外电子层的能量都相同吗?
提示:含有多个电子的原子中,核外电子具有不同的能量,分层排布。
2.核外电子按能量高低分层排布:
2→8→18→…→2n2
电子总是尽先排布在能量最低的电子层里
“一低四不超” 相互联系,相互制约,应协同运用,不能孤立地理解其中的某一条。
4.核外电子排布的表示方法——原子结构示意图(以钠原子为例)
核电荷数为1~18号元素的原子结构示意图
根据离子和原子的电子数的关系进行变化
首先写出原子的结构示意图
拓展1:简单离子结构示意图的表示方法
核外电子数 = 质子数 + 所带电荷数
核外电子数 = 质子数 - 所带电荷数
核外电子数 = 质子数
拓展2:微粒所含电子数的计算
下表是稀有气体元素原子的核外电子排布:
我们知道结构决定性质,观察稀有气体元素原子的核外电子排布,并思考为什么稀有气体的性质稳定?元素的最外层电子和元素性质之间有什么样的关系?
原子的核外电子排布规律: (1)电子总是尽先由里向外排列(2)每个电子层最多可以容纳2×n2个电子(3)最外层最多可以容纳8个电子(K层为最外层时,最多容纳2个)(4)次外层最多容纳18个电子
根据上述规律,写出33号元素的原子结构示意图
探究1~18号元素原子核外电子排布中的特殊关系
H Be Al
H Li Na
He Be Mg
X、Y、Z为1~18号元素中的三种元素,X原子的最外层电子数是次外层电子数的2倍,Y原子的次外层电子数是最外层电子数的2倍,Z原子的次外层电子数是最外层电子数的4倍。则X、Y、Z三种元素可能的组合是( )A.C、Si、Mg B.Li、C、Mg C.C、Mg、Li D.C、O、Mg
探究原子和离子电子数和质子数的关系
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示作出自己的判断。(1)该微粒是中性微粒,这种微粒的符号是_______。(2)该微粒对应的单质是一种能与水剧烈反应的金属,这种微粒的符号是____。(3)该微粒带两个单位的负电荷,画出其中性原子的结构示意图____。(4)该微粒的还原性很弱,失去1个电子后变为原子,这种微粒的符号是______。
(1)简单离子中,质子数与核外电子数的关系
(2)与Ne电子层结构相同的阳离子有:Na+、Mg2+、Al3+;阴离子有:F-、O2-、N3-等。
3.A、B、C三种元素的原子序数依次为a、b、c,它们的离子An+、Bn-、Cm-具有相同的电子层结构,且n>m,则下列关系正确的是( )A.a>b>c B.a>c>bC.a=b+m+n D.a=c-n-m
二、原子结构与元素性质的关系
通过单质与水(或酸)的反应比较元素原子失电子能力在多数情况下,可以通过比较元素的单质与水(或酸)反应置换出氢气的难易程度来判断元素原子失电子能力的强弱。
既不易失电子又不易得电子
原子结构与元素性质的关系
1.金属元素的最外层电子数一定小于4吗?最外层电子数小于4的一定是金属元素吗?
【提示】观察元素周期表可知,如P、Bi均为金属元素,但其最外层电子数分别为6、5;而H最外层只有1个电子,He最外层只有2个电子,B最外层只有3个电子,但H、He、B均不是金属元素。
2.通过前面的学习,金属钠、镁在化学反应中表现还原性,而氧气、氯气在化学反应中表现氧化性,你能用原子结构的知识对这一事实进行解释吗?
【提示】钠原子(镁原子)最外层只有1个(2个)电子,较易失去电子,因此常表现还原性;而氧原子(氯原子)最外层有6个电子(7个电子),较易得电子,因此常表现氧化性。
各电子层最多容纳2n2个电子
1.某元素原子的原子核外有三个电子层,最外层有4个电子,该原子核内的质子数为( )A.14 B.15 C.16 D.17
2.以下有关原子结构的说法中,正确的是( ) A.原子核都是由质子和中子构成的 B.原子次外层电子数不一定都是8 C.稀有气体元素原子最外层电子数一定都是8 D.最外层电子数为2的元素易失电子,所以均具有强的还原性
氕( )原子核内只有一个质子,无中子
3.如图是某元素的原子结构示意图,下列说法正确的是( )A.该原子的核外电子数是16B.该原子在化学反应中容易失去6个电子C.该元素属于非金属元素,不能与氧元素形成化合物D.该原子的电子层数为6
【提示】该原子的核外电子数是2+8+6=16,A正确;该元素原子在化学反应中易得到2个电子而形成带2个单位负电荷的阴离子,B错误;该元素原子的最外层电子数是6,大于4,为非金属元素,能与氧元素形成化合物,C错误;该原子的电子层数为3,D错误。
鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第1节 原子结构与元素性质课堂教学课件ppt: 这是一份鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第1节 原子结构与元素性质课堂教学课件ppt,共60页。PPT课件主要包含了NO1,水或酸,NO2,NO3等内容,欢迎下载使用。
化学鲁科版 (2019)第1节 原子结构与元素性质教案配套课件ppt: 这是一份化学鲁科版 (2019)第1节 原子结构与元素性质教案配套课件ppt,共27页。PPT课件主要包含了内容索引,素养目标,NaMg,更活泼,KNa,答案C等内容,欢迎下载使用。
化学第1节 原子结构与元素性质授课课件ppt: 这是一份化学第1节 原子结构与元素性质授课课件ppt,共60页。PPT课件主要包含了NO1,水或酸,NO2,NO3等内容,欢迎下载使用。













