



人教版 (2019)第三节 化学键第2课时巩固练习
展开
这是一份人教版 (2019)第三节 化学键第2课时巩固练习,共33页。PPT课件主要包含了导入新课,形成稳定的氯气分子,共用电子对,3分类,归纳总结,分子聚集,范德华力,课堂小结,达标检测,离子键和共价键等内容,欢迎下载使用。
也许你会问,为什么2个氢原子结合成氢分子,2个氯原子结合成氯分子,而不是3个、4个呢?为什么一个氢原子和一个氯原子结合成氯化氢分子,而不是以其他的个数比相结合呢?
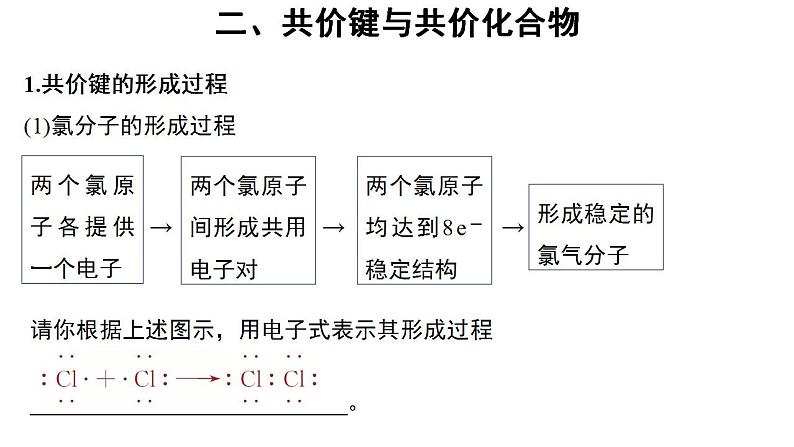
两个氯原子间形成共用电子对
两个氯原子均达到8e-稳定结构
1.共价键的形成过程(1)氯分子的形成过程
两个氯原子各提供一个电子
请你根据上述图示,用电子式表示其形成过程。
二、共价键与共价化合物
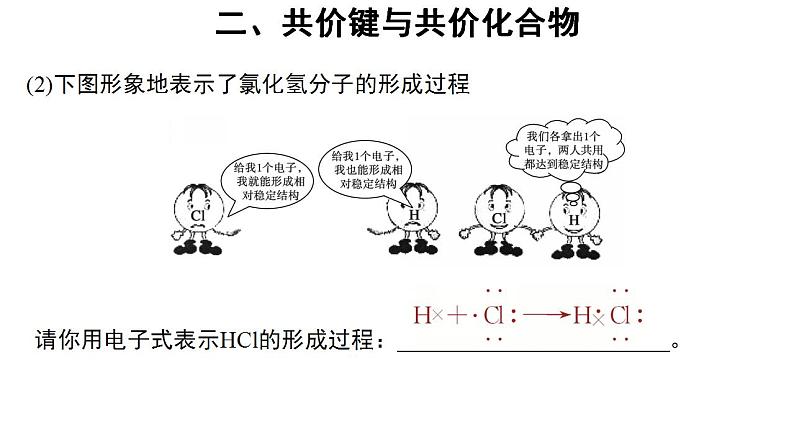
(2)下图形象地表示了氯化氢分子的形成过程
请你用电子式表示HCl的形成过程: 。
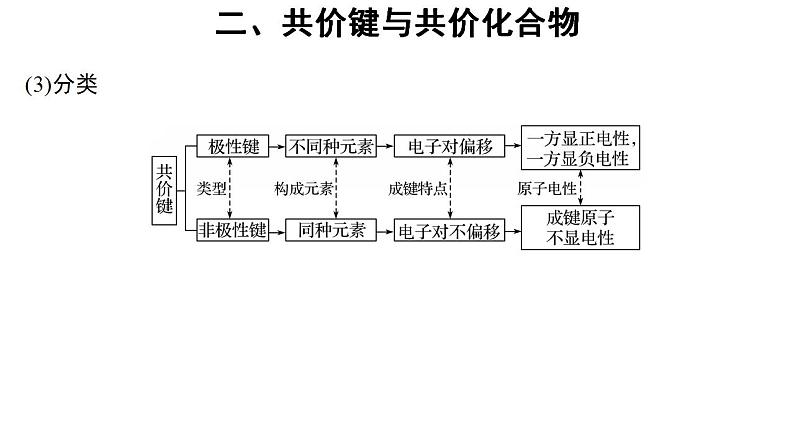
2.共价键(1)概念:原子间通过 所形成的相互作用。(2)成键三要素:①成键微粒:原子。②成键元素:一般是同种的或不同种的非金属元素。③成键条件:成键前原子最外层电子未达到饱和状态。
3.共价化合物(1)概念:以 形成分子的化合物。(2)四种常见的共价化合物①非金属氢化物:如NH3、H2S、H2O等。②非金属氧化物:如CO、CO2、SO2等。③酸:如H2SO4、HNO3等。④大多数有机化合物:如CH4、CH3CH2OH等。
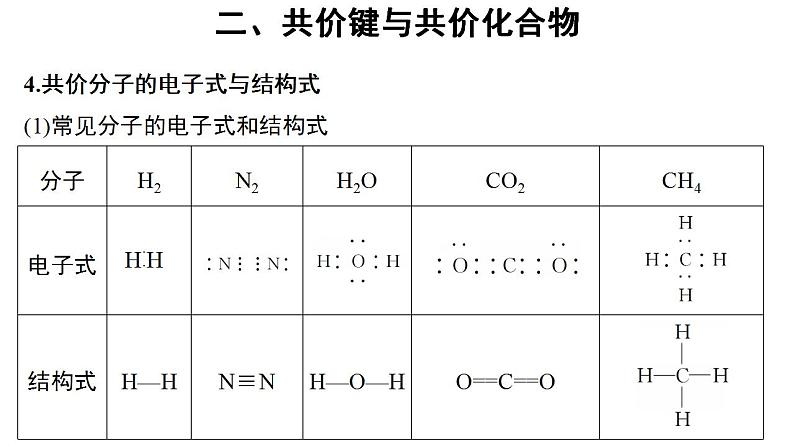
4.共价分子的电子式与结构式(1)常见分子的电子式和结构式
(2)用电子式表示共价分子的形成过程①H2: 。②NH3: 。③CO2: 。
(1)含有共价键的分子不一定是共价化合物。例如H2、O2等单质。(2)含有共价键的化合物不一定是共价化合物。例如NaOH、Na2O2。(3)离子化合物中可能含有共价键,共价化合物中一定不含离子键,只有共价键。
例1 下列叙述中,不正确的是A.含有共价键的物质一定是共价化合物B.H2O2中既含有极性键又含有非极性键C.CaO和NaCl晶体熔化时要破坏离子键D.H2SO4熔融态不导电
解析 部分非金属单质如O2、N2中含有共价键,但不属于化合物;某些离子化合物如NaOH中既含有离子键又含有共价键。
例2 下列分子的电子式书写正确的是A.氨气 B.四氯化碳 C.氮气 D.二氧化碳
1.化学键(1)化学键概念:使 的作用力。(2)分类
(3)化学反应的本质:一个化学反应过程,本质上就是旧化学键的 和新化学键的 过程。
离子相结合或原子相结合
三、化学键与分子间作用力
2.分子间作用力(1)概念:分子间存在一种把 在一起的作用力,叫作分子间作用力,又称 。(2)主要特征:①广泛存在于分子之间;②只有分子充分接近时才有分子间的相互作用力,如固体和液体物质中;③分子间作用力远远比化学键弱;④由分子构成的物质,其熔点、沸点、溶解度等物理性质主要由分子间作用力大小决定。
3.氢键(1)像H2O、NH3、HF这样的分子之间存在着一种比分子间作用力稍强的相互作用,这种作用使它们只能在较高的温度下才汽化,这种相互作用叫 。(2)氢键不是化学键,通常把氢键看作是一种 的分子间作用力。氢键比化学键 ,比分子间作用力 。(3)分子间形成的氢键会使物质的熔点和沸点 ,对物质的水溶性有影响,如氨极易溶于水,主要是氨分子与水分子之间易形成氢键。
化学键、分子间作用力和氢键的比较
例3 关于化学键的下列叙述中,正确的是①化学键只存在于分子之间 ②化学键只存在于相邻原子或离子之间 ③化学键是一种静电作用 ④化学键是相邻原子之间强烈的相互吸引 ⑤离子化合物可能含共价键 ⑥共价化合物可能含离子键 ⑦金属和非金属只能形成离子键 ⑧两个非金属和非金属原子间只能形成共价键A.②③④⑦ B.②③⑤⑧C.②④⑤⑥ D.①③⑤⑧
解析 离子化合物、共价化合物等都含有化学键,分子之间存在分子间作用力,故①不正确;化学键是相邻原子或离子之间强烈的相互作用,故②正确,离子键就是阴、阳离子之间的一种静电作用,相互吸引相互排斥,故③正确;化学键是相邻原子之间强烈的相互作用,故④不正确;含有离子键的化合物是离子化合物,全部由共价键形成的化合物是共价化合物,共价化合物中一定不含离子键,所以⑤⑧正确,⑥⑦不正确。
例4 下列物质发生变化时,所克服的粒子相互作用属于同种类型的是A.液溴和苯分别受热变为气体B.干冰和氯化铵分别受热变为气体C.食盐和冰的熔化D.食盐和葡萄糖分别溶解在水中
解析 液溴和苯受热变成气体均需克服分子间作用力,A项正确;干冰受热变成气体克服分子间作用力,氯化铵受热变成氯化氢和氨气,破坏化学键,B项错误;食盐熔化时,破坏了离子键,冰熔化时破坏了分子间作用力和氢键,C项错误;食盐溶解在水中,破坏了化学键,葡萄糖溶解在水中,破坏了分子间作用力,D项错误。
1.判断正误(正确的打“√”,错误的打“×”)(1)化学键既可存在于原子之间,又可存在于分子之间( )(2)在水中氢、氧原子间均以化学键相结合( )(3)由电离方程式HCl===H++Cl-可知,HCl分子中存在离子键( )(4)加热熔化氯化钠晶体和加水溶解氯化氢时,均发生化学键的断裂( )(5)非极性键可能存在于单质分子、共价化合物、离子化合物中( )
(6)不同非金属元素形成的化合物中可能存在非极性键( )(7)H与O、H与N均可形成既含极性共价键又含非极性共价键的化合物( )(8)NaHCO3、HCOONa均含有离子键和共价键( )(9)SO3和水反应形成的化合物是离子化合物( )(10)有化学键断裂或形成的变化一定是化学变化( )
2.关于共价键的说法正确的是A.金属原子在化学反应中只能失去电子,因而不能形成共价键B.由共价键形成的分子可以是单质分子,也可以是化合物分子C.共价键只能在不同原子之间形成D.稀有气体分子中只存在共价键
解析 金属和非金属化合时也能形成共价键,如AlCl3分子中的Al—Cl键是共价键;在H2、O2、N2、HCl、NH3分子中均存在共价键;H2、Cl2分子中的H—H键和Cl—Cl键都是共价键;稀有气体分子本身就已达到8电子或2电子稳定结构,不存在共用电子对,所以无共价键。
3.下列关于共价键与共价化合物的叙述中正确的是①含金属元素的化合物一定不是共价化合物②共价化合物中一定只含有共价键③共价化合物中一定不含离子键④含有共价键的化合物一定是共价化合物⑤离子化合物中可能含有共价键A.②③⑤ B.②③④⑤C.②③④ D.①②③⑤
解析 含金属元素的化合物可能是共价化合物,如氯化铝,①错误;只含有共价键的化合物是共价化合物,②正确;共价化合物只含有共价键,一定不含离子键,③正确;只含有共价键的化合物一定是共价化合物,④错误;离子化合物中可能含有共价键,如氢氧化钠含有离子键和共价键,⑤正确;故A正确。
4.下列化学用语中,正确的是A.次氯酸的结构式:H—O—ClB.氮气的电子式: C.CO2分子的电子式:O==C==OD.用电子式表示氯化氢分子的形成过程:
解析 Cl只能形成一对共用电子对,次氯酸的结构式为H—O—Cl,故A正确;
氮气中存在氮氮三键,氮气的电子式为 ,故B错误;
二氧化碳属于共价化合物,分子中存在两个碳氧双键,二氧化碳的电子式为 ,故C错误;
氯化氢是共价化合物,不存在离子键,氢原子与氯原子之间形成1对共用电子对,氯原子最外层有7个电子,氯化氢分子的形成过程: ,故D错误。
5.下列物质的变化过程中,有共价键明显被破坏的是A.从NH4HCO3中闻到了刺激性气味B.NaCl颗粒被粉碎C.I2升华D.NaOH溶于水
解析 C项,I2升华破坏分子间作用力;D项,NaOH溶于水破坏离子键。
6.某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为____________。
解析 N2分子内含有三键,氮原子间形成三对共用电子对,其电子式为 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为____(已知该反应为置换反应)。
解析 Na与Fe2O3发生置换反应,故生成的还原产物为Fe。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为_______________,K的原子结构示意图为________。
相关试卷
这是一份化学人教版 (2019)第四章 物质结构 元素周期律第三节 化学键优秀当堂达标检测题,共15页。试卷主要包含了离子键等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第三节 化学键同步达标检测题,共5页。试卷主要包含了了解离子键,了解电子式的表示方法,了解离子化合物,了解化学反应过程的本质,共价键的分类等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册第三节 化学键课时练习,共6页。










