






高中化学必修一 专题1.3.2 氧化剂、还原剂 (共30张)
展开
这是一份高中化学必修一 专题1.3.2 氧化剂、还原剂 (共30张),共30页。
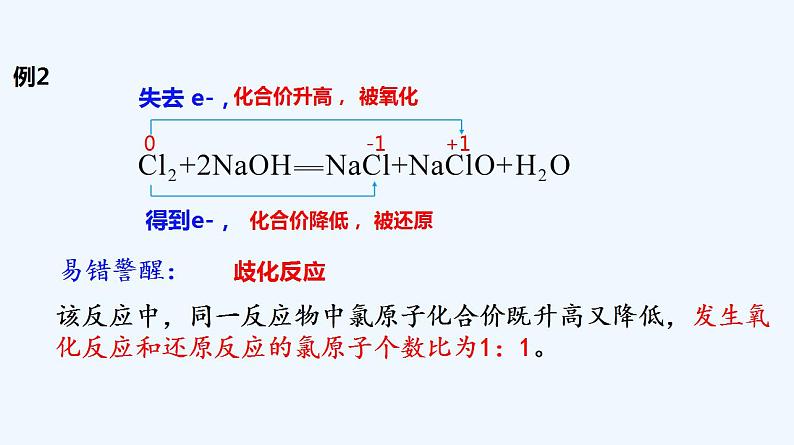
第一章 物质及其变化 第三节 氧化还原反应 第2课时 氧化剂 还原剂 练习回顾口诀:升失氧;降得还+3 0 0 +3得到2x3e-,失去2x3e-,化合价降低,被还原化合价升高,被氧化置换反应铝铁失去得到氧化还原氧化还原学习任务一:氧化还原反应中电子转移的表示方法1.双线桥法表示反应前后__________由反应物转化为生成物时电子转移的情况。同一元素(1)基本步骤标价态正确标出反应前后各元素化合价明确变价元素的化合价升降关系连双线一条线始于反应物中的降价元素,止于产物中同种元素另一条线始于反应物中的升价元素,止于产物中同种元素注得失正确标出反应前后“得到”电子或“失去”电子总数(2)注意事项(3)巧记口诀①箭头、箭尾必须对应化合价变化的同种元素的原子;②双线桥上必须注明“得到”或“失去”;③反应中转移电子数=氧化剂“得”电子数=还原剂“失”电子数先标化合价,再看价变化;起止同元素,桥上标变化。难点——“得”“失”电子数目判断单个Fe原子得到3个电子两个Fe原子单个Al原子失去3个电子两个Al原子小结:电子转移数=“得”或“失”电子数 =变价原子数×单个变价原子得(失)电子数用双线桥法表示下列方程式电子转移的方向和数目+4 -1 +2 0 得到2 e-,化合价降低,被还原被氧化化合价升高,失去2 ×e-,易错警醒:该反应中,只有一部分氯原子化合价发生变化,还有一部分氯原子价态不变,故失去电子数为2×e-,而不是4 ×e-。部分氧化还原反应反应例1:例2 0 -1 +1失去 e-,化合价升高,被氧化被还原化合价降低,得到e-,易错警醒:该反应中,同一反应物中氯原子化合价既升高又降低,发生氧化反应和还原反应的氯原子个数比为1:1。歧化反应例3-2 +4 0 失去 2×2e-,化合价升高,被氧化被还原化合价降低,得到4e-,易错警醒:该反应中,不同反应物中的硫原子化合价既升高又降低,发生氧化反应和还原反应的硫原子个数比为2:1。归中反应表示反应过程中__________原子间的电子转移情况。不同元素 0 +3 0 +3 意义:表示电子转移的方向及数目。反应中,Al失去6e-,化合价升高;Fe得到6e-,化合价降低,电子转移方向由Al指向Fe。6e-2.单线桥法(1)基本步骤标价态正确标出反应前后各元素化合价明确变价元素的化合价升降关系连单线始于反应物中的升价元素,止于反应物中降价元素注数目正确标出反应中转移的电子总数注意:不需要标明“得到”或“失去”注意:要用箭头标明电子转移的方向单线桥和双线桥两种表示方法的形式不同,实质相同——氧化还原反应电子转移关系,可以帮助我们理解氧应还原反应相关概念间的联系。在表示电子转移的方向和数目时用“单线桥”方便。在分析氧化还原反应中电子转移、化合价升降、物质被氧化、被还原等关系时,用“双线桥”方便;评价任务一1、判断下列反应中,电子转移表示方法正确的是( ) B、2Na+2H2O=2NaOH+ H2↑C、Cl2+2FeCl2=2FeCl3 +5 -1 0 0 +2 +3 -10 +12e-失去2e-得到2e-B学习任务二、氧化剂、还原剂红酒中添加SO2具有抗氧化的作用食品包装中的脱氧剂——还原铁粉1.氧化还原反应的基本概念氧化剂:得到(或电子对偏向)电子化合价降低的物质。 还原剂:失去(或电子对偏离)电子化合价升高的物质。CuO + H2 === Cu + H2O △2e- 氧化剂还原剂2e- 氧化剂还原剂例如:氧化性和还原性:氧化性:物质得电子性质,氧化剂具有氧化性。 且物质得电子越容易氧化性越强 还原性:物质失电子性质,还原剂具有还原性。 且物质失电子越容易还原性越强 什么剂具有什么性氧化产物、还原产物氧化产物:还原剂被氧化后的生成物。还原产物:氧化剂被还原后的生成物。还原剂:H2氧化剂:CuO被还原还原产物:Cu被氧化氧化产物:H2O思考与交流1、分析下列反应化合价变化,电子转移情况,并指出在反应中谁是氧化剂?还原剂?氧化产物?还原产物?2、总结氧化还原反应基本概念之间的相互关系,构建氧化还原反应概念模型MnO2 + 4HCl = MnCl2+Cl2↑+2H2O△氧化剂还原剂氧化产物还原产物MnO2HClMnCl2Cl2 +4 -1 +2 0化合价降低, 得2e-, 被还原化合价升高, 失2×e-电子, 被氧化得电子降低还原反应(被还原)还原产物失电子升高氧化反应(被氧化)氧化产物氧化性还原性小结:氧化还原反应基本概念氧化剂 + 还原剂 = 还原产物 + 氧化产物得电子,化合价降低,被还原失电子,化合价升高,被氧化构建氧化还原反应概念模型:升—失—氧化——还原剂, 降—得—还原——氧化剂。口诀:2、常见的氧化剂、还原剂⑴氧化剂: 具有氧化性,易得电子,高价态物质。O2 , Cl2 CuO , Fe2O3 KMnO4 , K2Cr2O7 , 浓H2SO4 , HNO3 , KClO3Fe3+ , H+1)活泼的非金属单质:2)高价的氧化物:3)高价的含氧酸及其盐:4)某些阳离子:⑵还原剂: 具有还原性,失电子,低价态物质 另外,具有中间价态的化合物,在氧化还原反应中既能得到电子又能失去电子,既能做氧化剂又能做还原剂,例如H2O2、SO2、SO32-等。(1)活泼的金属单质:K , Na , Mg , Fe , Al(2)某些非金属单质: H2 , C(3)变价元素的低价态物质: CO ,H2S, Cu2O (4)某些阴离子: I-, S2-(1)2H2+O2===2H2O(2)4P+5O2===2P2O5(3)Fe+H2SO4===FeSO4+H2↑(4)2HgO===2Hg+O2↑点燃加热点燃氧化剂:O2还原剂:H2氧化剂:O2还原剂:P氧化剂:H2SO4还原剂:Fe氧化剂:HgO还原剂:HgO1、(教材P26、第10题)分析下列氧化还原反应中元素化合价的变化情况,指出氧化剂和还原剂。评价任务二2.(教材P25、第7题)下列反应中,HCl做还原剂的是 ( ),HCl做氧化剂的是 ( )。A.NaOH+HCl==NaCl+H2OB.Zn+2HCl==ZnC12+H2↑C.MnO2+4HCl(浓 )==MnCl2+2H2O+Cl2↑D.CuO+2HCl==CuCl2+H2O△CB口诀:升—失—氧化——还原剂, 降—得—还原——氧化剂。3.(教材P25、第8题)实现下列物质之间的转化,需要加入还原剂才能实现的是 ( )。A. SO3→ H2SO4B.Cu→ Cu(NO)3C. CuO→ CuD.CO→ CO2氧化剂 + 还原剂 = 还原产物 + 氧化产物【分析】A中无化合价升降;B中铜元素化合价升高,作还原剂,被氧化,需加入氧化剂;C中铜元素化合价降低,作氧化剂,被还原,需加入还原剂;D中碳元素化合价升高,作还原剂,被氧化,加入氧化剂。C(1)H2O2+H2S=2H2O+S↓(2)H2O2+Cl2==2HC1+O2(3)2H2O2 ===2H2O+O2↑4、(教材P26、第11题)从氧化剂和还原剂的角度,分析下列三个反应中H2O2的作用。 MnO2H2O2作氧化剂H2O2作还原剂H2O2既是氧化剂又是还原剂还原剂氧化剂 目前,汽车尾气系统中均安装了催化转化器(如图⒈17)。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成CO2和N2。(1)请写出上述反应的化学方程式。(2)请分析上述反应是否为氧化还原反应。 如果是,请指出反应中的氧化剂和还原剂。 +2 +2 +4 0化合价升高, 失2×2e-, 被氧化化合价降低, 得2×2e-电子, 被还原氧化产物还原产物教材P24【思考与讨论】NO、CO均有毒,二者在催化剂作用下发生氧化还原反应,生成的产物N2,和CO2,都是无毒物质,从而减少了汽车尾气排放所造成的空气污染。(3)催化转化器中发生的反应对减少汽车尾气污染有什么作用?请查阅资料,了解氧化还原反应在生产和生活中应用的其他具体事例,与同学讨论你对氧化还原反应价值的认识。教材P24【思考与讨论】 氧化还原反应是一类重要的化学反应类型,广泛存在于日常的生产生活中。有益于人类生活的氧化还原反应有害人类生活的氧化还原反应 氧化还原反应是一类重要的化学反应类型,广泛存在于日常的生产生活中。
相关课件
这是一份人教版 (2019)必修 第一册第三节 氧化还原反应教学ppt课件,共32页。PPT课件主要包含了素养要求,氧化剂与还原剂,课堂检测等内容,欢迎下载使用。
这是一份高中化学第三节 氧化还原反应课文配套课件ppt,共32页。PPT课件主要包含了双线桥法,标价态,连双线,注得失,不同元素,连单线,注数目,①氧化性和还原性,还原产物,氧化还原反应基本概念等内容,欢迎下载使用。
这是一份苏教版 (2019)必修 第一册第一单元 氯气及氯的化合物精品ppt课件,共24页。PPT课件主要包含了知识回顾,双线桥,单线桥,学习目标,氧化剂和还原剂,氧化剂,还原剂,新知探究,氧化反应被氧化,还原产物等内容,欢迎下载使用。










