

高中化学必修一 专题4.1.2 元素周期表
展开第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第2课时 元素周期表
(1)通过了解元素周期表的结构,认识原子结构与元素在周期表中位置间的关系。
(2)知道质量数和的含义,知道元素、核素、同位素的含义。
【内容分析】
本节内容主要讲述元素周期表的结构。关于元素周期表,学生在初中已了解概貌,教材中这部分内容编写的目的是要使学生了解和熟悉周期表的结构。本节采用“思考与讨论”的方式,让学生发现、归纳原子结构与周期表的关系,这里重点讨论的是周期表的族序数(“位”)与原子核外电子(“构”)的关系,为后面讨论元素性质打下基础。之后呈现的核素的知识,是对元素概念的扩大,教材是从周期表的同“位”与原子核(“构”)的关系这一 视角来讨论的。有关放射性同位素的知识,中学物理中已有较多的介绍,此处只是简单介绍应用。元素周期表与核素这两部分内容,可以使学生初步建立“构”“位”“性”的关系。
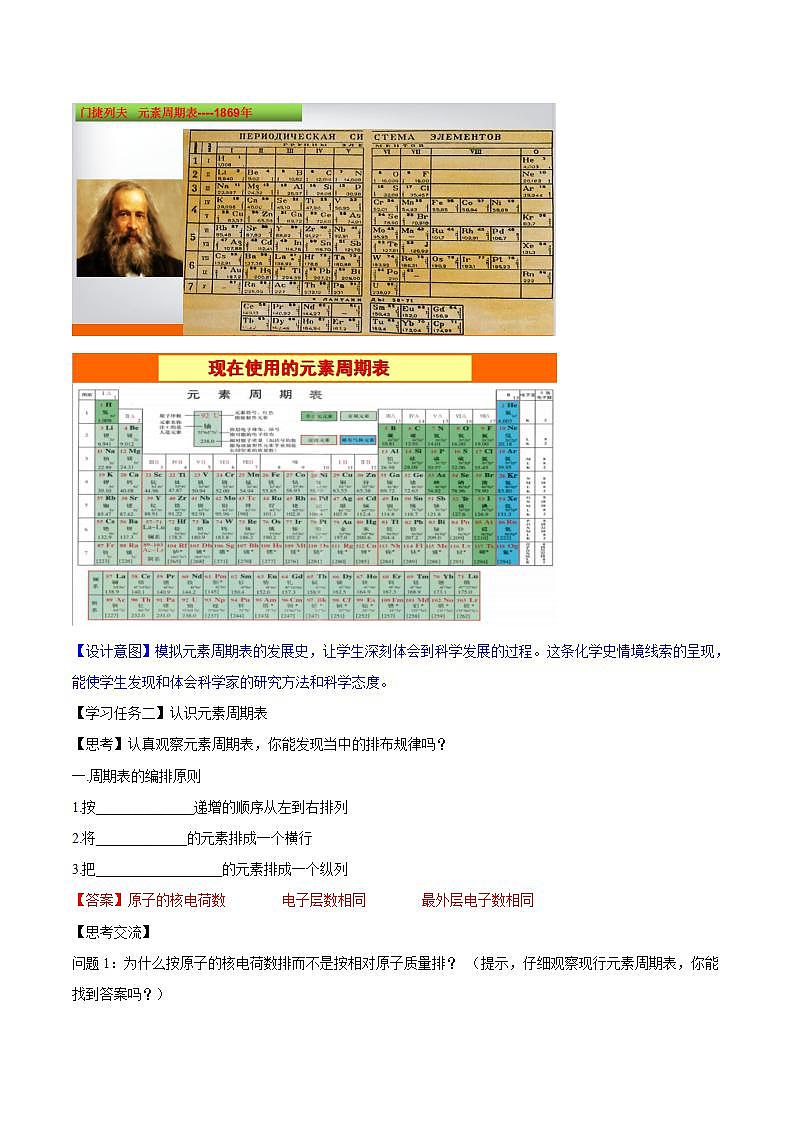
元素周期表的发现过程,充分体现了科学研究方法、观念和科学精神,教材在本节特别重视化学史情境的创设。通过节引言、元素周期表的引人段落、科学史话、研究与实践等形式,呈现周期表的发现过程和意义。例如,在元素周期表的引人段落,以门捷列夫编制第一张周期表引入,并特别强调其是“在前人研究的基础上”编制出来的;在科学史话“元素周期表的发展”中,简述了门捷列夫周期表之前的基础和之后的发展;在研究与实践“认识元素周期表”中,还以学生体验的形式,通过关注周期表发展过程中的不同形式,引导学生认识和理解周期表。这条化学史情境线索的呈现,能使学生发现和体会科学家的研究方法和科学态度。此外,本节内容还可以开展“我为元素X代言”的项目式学习,这样有利于培养学生的学科素养。
【教学重点和难点】
重点:元素周期表的结构
【教学流程】
【学习任务一】了解元素周期表的发展历史
已知铯和碘的原子结构示意图,请联系1~20号元素的原子结构示意图,并对这22种元素进行分类。你的分类依据是?
1.按金属元素和非金属元素分类
2.按状态分类(固态、气态)
3.按电子层不同分类
4.按最外层电子数分类
【思考】分类以后,又该如何进一步认识这些元素呢?回顾历史,在没有知道原子的结构之前,科学家们是如何系统认识元素的呢?
1789年,法国化学家拉瓦锡在其写就的《化学概要》里,列出了第一张化学元素表,元素被分为简单金属物质、非金属物质等四大类。
1829年,德国化学家德贝莱纳根据元素性质的相似性提出了“三素组”学说。将当时已知的54种元素中的15种分成5组,如锂、钠、钾;氯、溴、碘;钙、锶、钡。
【设计意图】模拟元素周期表的发展史,让学生深刻体会到科学发展的过程。这条化学史情境线索的呈现,能使学生发现和体会科学家的研究方法和科学态度。
【学习任务二】认识元素周期表
【思考】认真观察元素周期表,你能发现当中的排布规律吗?
一.周期表的编排原则
1.按______________递增的顺序从左到右排列
2.将_____________的元素排成一个横行
3.把__________________的元素排成一个纵列
【答案】原子的核电荷数 电子层数相同 最外层电子数相同
【思考交流】
问题1:为什么按原子的核电荷数排而不是按相对原子质量排? (提示,仔细观察现行元素周期表,你能找到答案吗?)
按质子数排更加科学。若按相对原子质量排,部分元素位置发生颠倒。如Ar和K,又如Te和I。
问题2:为什么Ar一定要放在K之前?这两者颠倒会有什么影响?
两者颠倒导致周期表的编排出现混乱(横行不一定电子层相同,纵列不一定最外电子层相同)。
提示:需要了解哪些是短周期、哪些是长周期、每周期元素的种类数目
结论:周期序数=电子层数
认真观察元素周期表,回答下列问题:
1. 在元素周期表中有多少纵行 ?
2. 族分几种,分别用什么符号表示?
族序数用什么数字表示?
每一纵行对应哪一族?
3. 周期表中所含元素种类最多的族是哪一族?
三.周期表的族
每一个纵列叫做一个族(18纵列)
1.主族:(7个)由短周期元素和长周期元素共同构成的族。表示方法:在族序数(罗马数字)后标一“A”字。ⅠA(除氢以外称为碱金属)、ⅡA、ⅢA、…VIIA(卤族)
2. 副族:(7个) 完全由长周期元素构成的族。表示方法:在族序数后标“B”字。如ⅠB、ⅡB、ⅢB、…
3. 第VⅢ族:(第8到10纵列)
4. 0族:(稀有气体)
【学习任务三】认识核素与同位素
【思考】元素周期表中的每个方格中,一般都标有元素的基本信息,你知道这些信息的含义吗?
【思考】为什么H的相对原子质量1.008,这个数值是怎么来的?
【思考】比较三种原子结构的异同,它们是不是同一种元素?
元素:具有相同核电荷数(或质子数)的同一 类原子的总称。
【思考】它们是不是同一种原子?
不是,它们是三种不同的原子,或者说是三种不同的核素。
核素:具有一定数目的质子和一定数目的中子的一种原子。
【拓展】如图H的三种核素可以在周期表的同一小方格中表示出来。(中学阶段一般提供显示质量数等信息的周期表)
同位素:质子数相同而中子数不同的同一种元素的不同原子互称为同位素。即同一元素的不同核素之间互称为同位素。
【思考】除了用名称区分同一元素的同位素外,还可以怎样区分?
【思考】每个原子的左上角和左下角分别表示什么?你能表示出某核素X的原子符号吗?
【思考】在周期表中收入了118种元素,是不是就只有 118种原子呢?
一种元素可有几种原子,故元素种类118种,而原子1800多种。其中,除了天然存在的同位素外,科学家还利用核反应制造出很多种同位素。
【问题解决】为什么H的相对原子质量1.008,这个数值是怎么来的?
元素的相对原子质量
元素的相对原子质量是其各种核素的相对原子质量分别与各种核素在自然界里的丰度(某种核素在这种元素的所有天然核素中所占的比例)的乘积之和。例如,氢元素的三种核素: 氕,相对原子质量为1.0079,其丰度为99.985%, 氘相对原子质量为2.014,其丰度为0.015%,氚,痕量(计算时忽略)。因此,氢元素的相对原子质量为1.0079*99.985%+ 2.014*0.015% ≈1.008。
【拓展1】同位素中,有些具有放射性,称为放射性同位素。
【拓展2】各种同位素原子的物理性质有所不同,但它们的化学性质基本相同。
【拓展3】同位素在生活、生产和科学研究中有着重要作用。
同位素的应用:
1、作核燃料:作制造核武器的动力性材料(235U)
2、金属探伤:利用γ射线的贯穿本领,可以检查金属内部有没有沙眼和裂纹。
3、辐射育种:利用放射性同位素的射线对遗传物质产生影响,提高基因突变频率,从而选育出优良品种。
4、临床治癌:利用放射性同位素的射线杀伤癌细胞或阻止癌细胞分裂。
5、环保治污:利用放射性同位素的射线可消毒灭菌,杀死各种病原体从而能保护环境使其少受污染。
......
CT(Computed Tomography),即电子计算机断层扫描,它是利用精确准直的X线束、γ射线、超声波等,与灵敏度极高的探测器一同围绕人体的某一部位作一个接一个的断面扫描,具有扫描时间快,图像清晰等特点,可用于多种疾病的检查;根据所采用的射线不同可分为:X射线CT(X-CT)以及γ射线CT(γ-CT)等。
质子治疗最早于1946年首次被提出,1954年,美国劳伦斯伯克利国家实验室的研究团队进行了世界首例肿瘤患者的质子治疗。此后,美国、欧洲、日本等相继开始了质子在医学领域的研究,但直到1988年,质子治疗才获得了美国FDA的批准,质子治疗从此开始在肿瘤治疗领域大放异彩。
质子治疗最大的优势就是比常规放疗更加精准地杀伤肿瘤组织。质子束使其具有手术刀般的精确性。与X射线的光子不同,质子以极高速度进入患者体内后质子减慢,它们与人体组织相互作用,这样一来,大部分光束能量沉积在一个点上(称为布拉格峰),故而拥有绝佳的精准性、对周围正常组织器官损伤微小,这对大多数需要接受放疗的患者来讲,质子治疗可能是最好的治疗方法之一。
【思考】原子形成离子之后构成原子的微粒哪些发生了变化?
电子数变了
【思考】请用原子符号表示出某核素在得到或失去n个电子后的情况。你能总结出原子、阳离子和阴离子核外电子数与质子数的关系吗?
【评价任务一】
在元素周期表中找到以下元素,并写出它的原子结构示意图和在元素周期表中的位置。
【评价任务二】
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,请回答:
(1)写出下列元素符号:甲:____乙:____丙:____丁:____戊:____己:____
(2) 丙与庚的原子核外电子数相差_________
(3)乙与丙的原子核外电子数相差_________
己与庚的原子核外电子数相差_________
【答案】(1)甲:Li 乙:Na 丙:K 丁:Ca 戊:C 己:Si
(2)13 (3)8 18
【思考与讨论】
引导学生观察元素周期表,经过思考、讨论后填写表格;再根据表格归纳总结,从而得出结论:周期序数=原子核外电子层数。
类似的这种讨论可以延续到对元素周期表中族的学习。通过比较同主族元素原子的最外层电子数得出结论:主族序数=最外层电子数。
【科学史话】
18世纪,元素不断被发现,种类越来越多。化学家开始对它们进行分类和整理,以求发现系统的元素体系。1789年,拉瓦锡在《化学概要》一书中提出了第一个元素分类表,此后,人们对元素体系的研究不断深入。1829年,德国化学家德贝赖纳( J.W.Dibereiner,1780-1849) 提出了“三素组”的概念,对于探寻元素性质的规律具有启发性。
1867年,俄国化学家门捷列夫在研究中开始触及到元素分类的规律性。为了进一步将元素进行分类,他把当时已经发现的63种元素中相对原子质量相近的元素排列在一起,并进行了反复研究,探索元素之间的规律性。门捷列夫克服了许多困难,终于在1869年2月编制了第一张元素周期表(如图4-7)。
其实早在1864年,德国化学家迈尔( J.L.Meyer, 1830- - 1895)在他的《现代化学理论》一书中已明确指出元素的相对原子质量的数值存在一种规律性,并画出了一张与门捷列夫第一张周期表十分相似的元素表。1870年, 他又发表了一张比1869年门捷列夫发表的周期表更完整的元素周期表。1880年,迈尔坦言道:“我没有足够的勇气作出像门捷列夫那样深信不疑的预言。门捷列夫编制的第一张元素周期表并不完整,如其中没有稀有气体元素。后来的化学发现终于使门捷列夫元素周期表变得完整。1905年,瑞士化学家维尔纳( A.Werner,1866- -1919, 1913年诺 贝尔化学奖获得者)制成了现代形式的元素周期表。1913年,英国物理学家莫塞莱(H.GJ.Moseley, 1887--1915)发现并证明了周期表中元素的原子序数等于原子的核电荷数,使人们对于元素周期表和元素周期律的认识更趋于完善。
【研究与实践】
一、认识元素周期表
[研究目的]
元素周期表自发现至今已有一百多年。随着人们对科学的认识不断深入,元素周期表也演变出多种形式。通过了解形式各异的元素周期表,加深对元素间的关系和其中所蕴含的科学方法的认识。
[研究任务]
(1)调查与整理。
①阅读教科书中的“科学史话一元素周期表的发展”, 并通过其他渠道收集相关信息,了解元素周期表发展的几个重要阶段,并认识其中有代表性的元素周期表及其特点。
②收集形式各异的元素周期表并分类整理,选择其中的2~3种,分析其设计的依据和特点。
(2)设计与制作。
通过调查与整理,并根据你对元素知识和分类方法的认识,自已试一试设计和制作元素周期表,说明设计依据和特点。
[结果与讨论]
(1)通过了解元素周期表的发现和发展过程,你得到什么启示?以此为基础,撰写研究报告,并与同学交流。
(2)展示自制的元素周期表,与同学交流。
二、我为X元素代言
上网查阅相关资料,如在周期表中的位置、结构特征、发现年代、在地壳中的含量、性质、用途等,可手工书写或打印在白纸上,上课展示,展示时对一些重要性知识应有板书,代言元素与学号对应,优秀代言资料将作为墙报展示。
【练习与应用】
【答案】
【答案】C
6.在元素周期表中找到金、银、铜、铁、锌、钛的位置(周期和族),并指出这些元素的核电荷数。
7.查阅元素周期表,从每个方格中可以得到哪些信息?以一-种元素为例,将你获得的信息用图表示
出来。
【答案】可获取的信息主要有:元素在周期表中的位置、原子序数、元素名称、元素符号、相对
原子质量等。示例如图所示。
高中化学必修一 专题4.2.2 元素周期表和周期律的应用解析版): 这是一份高中化学必修一 专题4.2.2 元素周期表和周期律的应用解析版),共1页。
高中化学选择性必修一 4.1.2化学电源 教案: 这是一份高中化学选择性必修一 4.1.2化学电源 教案,共3页。
高中化学必修一 专题4.2.2 元素周期表和周期律的应用: 这是一份高中化学必修一 专题4.2.2 元素周期表和周期律的应用,共9页。













