





高中化学必修一 专题4.1.1 原子结构
展开这是一份高中化学必修一 专题4.1.1 原子结构,共20页。
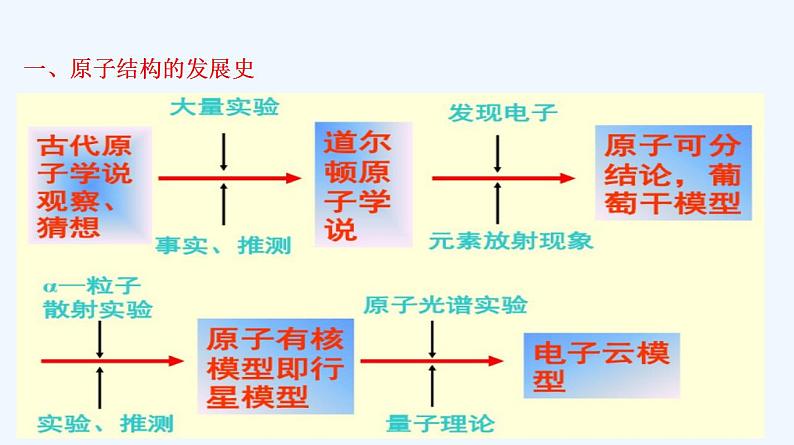
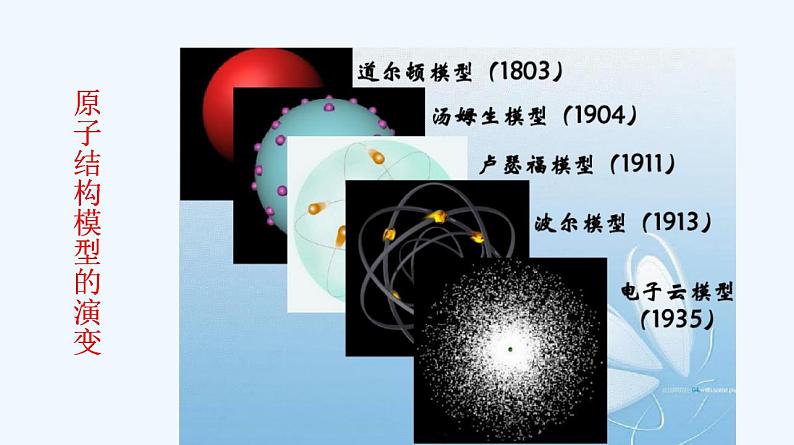
第四章 物质结构 元素周期律 第一节 原子结构与元素周期表第1课时 原子结构古人关于万物构成的思考:惠施(战国)的十个命题,主要是对自然界的分析,其中有些含有辩证的因素。他说:“至大无外,谓之大一;至小无内,谓之小一。”“大一”是说整个空间大到无所不包,不再有外部;“小一”是说物质最小的单位,小到不可再分割,不再有内部。古希腊哲学家德谟克利特(Democritus,约公元前460—公元前370)曾经指出,物质是由不可分割的微粒(也称为“原子”)构成的。原子真的是不可分割的球体吗? 【学习任务一】回顾历史,掌握模型构建的学习方法 一、原子结构的发展史 原子结构模型的演变 【思考】请从上述史料中总结出科学探究的一般过程。 如此不断循环! 二、原子结构 (2)质量数:质子和中子的相对质量都近似为1,忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。 质量数(A)=质子数(Z)+中子数(N)(1)原子呈电中性是因为中子不带电( )(2)质子数和中子数决定原子的质量( )(3)原子的质量数就是原子的相对原子质量( )(4)微粒中的质子数与核外电子数一定相等( )(5)某种氯原子的中子数是18,则其质量数是35,核外电子数是17( )×√××√【评价任务一】判断下列说法是否正确 ※高速运动,接近光速;※没有确定的轨迹,不能同时准确地测定电子在某一时刻所处的位置和运动速度,也不能描绘出它的运动轨迹。如何描述核外电子的运动? ※只能用统计的观点指出它在原子核外空间某处出现机会的多少。※用“电子云”形象地描述核外电子的运动。【思考】原子核外电子是如何运动的? 【学习任务二】理论探究,掌握原子结构 多电子的电子云图片 【思考】仔细观察图片,你有什么发现? 在含有多个电子的原子里,电子分别在能量不同的区域内运动。 (3)电子层 概念:在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层,称作电子层。【思考与讨论】由于原子中的电子是处在原子核的引力场中(类似于地球上的万物处于地心引力场中),电子一般总是先从内层排起,当一层充满后再填充下一层。下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?请思考并讨论下列问题。【小结】原子核外电子分层排布规律 (1)能量最低原理:核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。(2)电子层最多容纳的电子数①最外层电子数目最多不能超过8个(K层为最外层时不能超过2个)。②次外层最多能容纳的电子数不超过18个。倒数第三层不超过32 个电子。③各电子层最多容纳2n2个电子。如K、L、M、N层最多容纳的电子数分别为2、8、18、32。(4)请你根据所归纳的规律,用原子结构示意图表示核电荷数为1~20号元素原子的核外电子排布。实际上,原子核外电子排布的规律,是根据原子光谱和理论分析的结果而得出的,其中也包括从元素周期表得到的启示。【评价任务二】(1)当M层上有电子时,L层上的电子是否已排满? 由于L电子层能量比M层低,故电子先排满L层后再排M层;因此,当M层上有电子时,L层上一定排布8个电子。若钾原子的M层排布9个电子,此时M层就成为最外层,这和电子排布规律中的“最外层上排布的电子数不能超过8个”相矛盾,不符合电子排布的规律,即M层不是最外层时可排18个电子,而它作为最外层时最多只能排8个电子。(3)生物体在生命存续期间保留的一种碳原子——碳-14( )会在其死亡后衰变,测量考古遗址中发现的遗物里碳-14的数量,可以推断出它的存在年代。你知道碳-14的“14”是什么含义吗?这种碳原子的质子数、中子数、核外电子数分别是多少?碳-14的“14”是指这种碳原子的质量数为14,此碳原子的质子数为6、中子数为8、核外电子数为6。 1.某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示作出自己的判断。 (1)该微粒是中性微粒,这种微粒的符号是_____。(2)该微粒对应的单质是一种能与水剧烈反应的金属,这种微粒的符号是____。 NeNa+【评价任务三】 (3)该微粒带两个单位的负电荷,画出其中性原子的结构示意图________。(4)该微粒的还原性很弱,失去1个电子后变为原子,这种微粒的符号是___。F-2.已知A、B、C三种元素的原子中,质子数为A
相关课件
这是一份高中化学人教版 (2019)必修 第一册第四章 物质结构 元素周期律第一节 原子结构与元素周期表教学课件ppt,共34页。PPT课件主要包含了素养要求,原子结构,原子核外电子,当堂练习等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第一节 原子结构与元素周期表集体备课课件ppt,共27页。PPT课件主要包含了电子层,“四素”的区别等内容,欢迎下载使用。
这是一份人教版 (2019)第四章 物质结构 元素周期律第一节 原子结构与元素周期表示范课课件ppt,共16页。PPT课件主要包含了问题解决,化学与应用,同位素,现代电子云模型等内容,欢迎下载使用。













