


高中化学必修一 专题4.2.1 元素性质的周期性变化规律
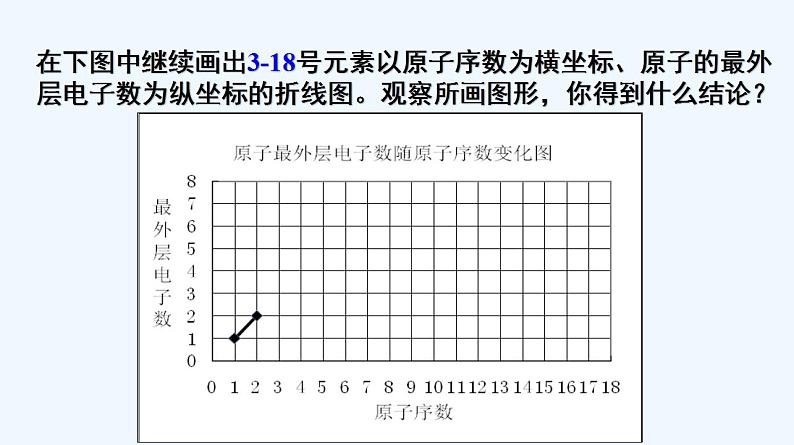
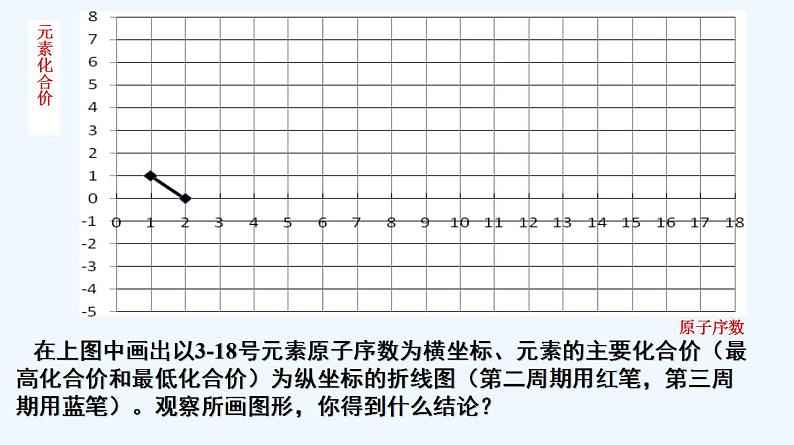
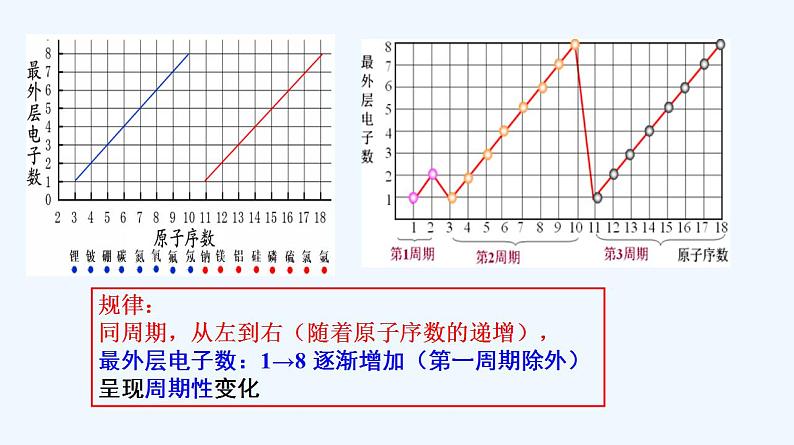
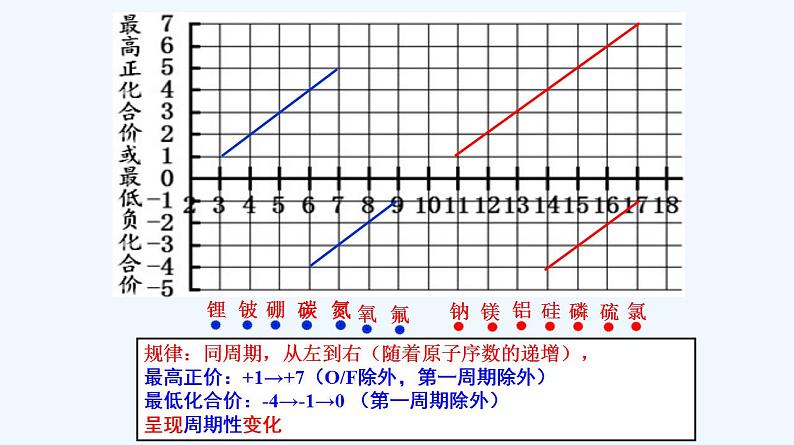
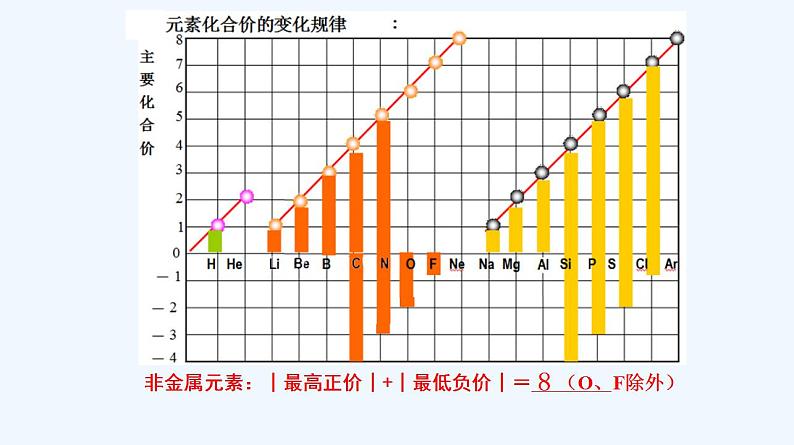
展开第四章 物质结构 元素周期律 第二节 元素周期律 第1课时 元素性质的周期性变化规律 思考:通过对碱金属元素、卤素的结构和性质的研究,我们已经知道同主族元素的性质有相似性和递变性。那么,同一周期的元素结构有什么相似性和递变性?性质又有什么变化规律?【学习任务一】同一周期元素原子结构的变化规律思考与讨论:观察表4-5,思考并讨论:随着原子序数的递增,元素原子的核外电子排布、原子半径和化合价各呈现什么规律性的变化? 在下图中继续画出3-18号元素以原子序数为横坐标、原子的最外层电子数为纵坐标的折线图。观察所画图形,你得到什么结论?元素化合价在上图中画出以3-18号元素原子序数为横坐标、元素的主要化合价(最高化合价和最低化合价)为纵坐标的折线图(第二周期用红笔,第三周期用蓝笔)。观察所画图形,你得到什么结论?原子序数规律:同周期,从左到右(随着原子序数的递增),最外层电子数:1→8 逐渐增加(第一周期除外)呈现周期性变化规律:同周期,从左到右(随着原子序数的递增),最高正价:+1→+7(O/F除外,第一周期除外)最低化合价:-4→-1→0 (第一周期除外)呈现周期性变化非金属元素:│最高正价│+│最低负价│=________ 8(O、F除外)结论: 11~18 3~10 1→01→211~2 最高或最低化合价变化最外层电子数 电子层数 原子序数 -4→-1→0+1→+521→831→8同周期,从左到右(随着原子序数的递增),最外层电子数:1→8 逐渐增加(第一周期除外)原子半径:大→小(稀有气体除外)最高正价:+1→+7(O/F除外,第一周期除外)最低化合价:-4→-1→0 (第一周期除外)原子半径的变化(不考虑稀有气体)呈周期性变化将上述结论填入P102的表格中 思考:结构决定性质。那么元素的金属性和非金属性是否也随着原子序数的递增而呈现周期性的变化呢?吸引力( )非金属性逐渐( )【学习任务二】同一周期元素性质的变化规律同周期左到右:电子层数同,原子半径↘ 失电子能力逐渐( )得电子能力逐渐( )如何用事实证明?以第三周期为例,证明金属性Na>Mg>Al,非金属性Si
人教版 (2019)必修 第一册第二节 元素周期律教学ppt课件: 这是一份人教版 (2019)必修 第一册第二节 元素周期律教学ppt课件,共33页。PPT课件主要包含了素养要求,元素性质的递变规律,当堂练习等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律集体备课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律集体备课课件ppt,共24页。PPT课件主要包含了最外层电子数1→2,最外层电子数1→8,原子半径逐渐减小等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律说课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律说课课件ppt,共24页。PPT课件主要包含了最外层电子数1→2,最外层电子数1→8,原子半径逐渐减小等内容,欢迎下载使用。













