






高中化学必修2 第3课时 硝酸酸雨及防治
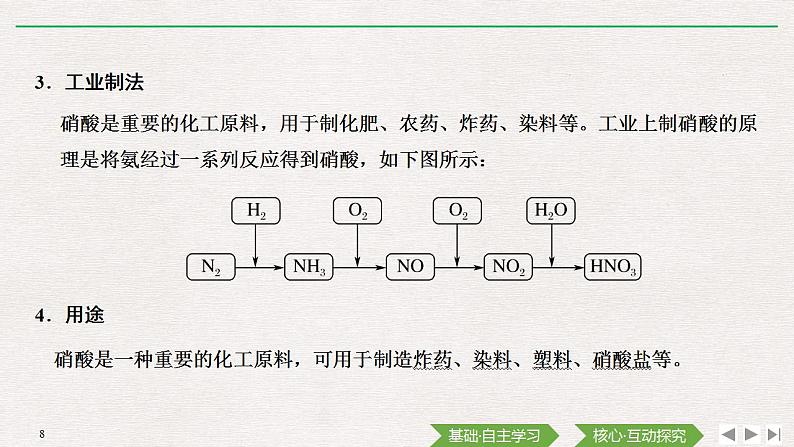
展开第3课时 硝酸 酸雨及防治[知识梳理]知识点一 硝酸此为硝酸的安全周知卡,硝酸的危险性类别为什么是“腐蚀”,浓、稀硝酸分别有什么样的性质?请学习下列知识点找到答案:1.物理性质纯硝酸为________色、有________气味的液体,沸点________,________挥发,在空气中呈“白雾”状,质量分数95%以上的浓硝酸称为“________硝酸”。无刺激性低易发烟2.化学性质(1)酸性:属于强酸,具有酸的通性,如CaCO3与HNO3反应_________________________________________________。(2)不稳定性:见光或受热易分解,化学方程式为___________________________________________。市售浓HNO3呈黄色,因硝酸分解产生的NO2溶在硝酸里,故浓HNO3应保存在棕色试剂瓶,置于冷暗处,不能用橡胶塞。CaCO3+2HNO3(稀)===Ca(NO3)2+CO2↑+H2O(3)强氧化性:①与金属反应:硝酸具有强氧化性,能与除________、________、________以外的大多数金属反应。a.Cu与浓HNO3反应的化学方程式为________________________________________。Cu与稀HNO3反应的化学方程式为_______________________________________。既表现HNO3的氧化性,又表现酸性,HNO3→NO2、NO,氧化性,HNO3→Cu(NO3)2,酸性注意:[实验5-8]的实验现象金铂钛Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2Ob.与Fe、Al反应:________时浓硝酸可使铁、铝表面形成致密的氧化膜而________,所以可以用________容器或________容器盛放浓硝酸。②与非金属反应:碳与浓硝酸反应的化学方程式为___________________________________________。只表现氧化性常温钝化铁铝3.工业制法硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示:4.用途硝酸是一种重要的化工原料,可用于制造炸药、染料、塑料、硝酸盐等。这是酸雨危害的漫画,酸雨为什么有这么大的危害,酸雨的成分是什么?酸雨如何防治?通过掌握以下知识解决这个问题:知识点二 酸雨及其防治正常雨水pH=5.6,是因为溶解了CO2SO22H2SO3+O2===2H2SO43NO2+H2O===2HNO3+NO微判断(1)金属与硝酸反应无H2放出是因为硝酸中N元素的化合价处于最高价态,其得电子能力强于H+( )(2)碳、铜分别与浓硝酸反应,浓硝酸均只表现强氧化性( )(3)浓硝酸能用铁制容器或铝制器存放是因为铝、铁与浓硝酸不反应( )(4)向浓硝酸中滴加石蕊溶液,现象为先变红后褪色( )√××√微训练1.已知3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,则下列说法不正确的是( )A.Cu做还原剂,HNO3做氧化剂B.HNO3在该反应中只有部分表现出了氧化性C.每生成22.4 L(标准状况)NO有3 mol电子转移D.如果有8 mol HNO3被还原,则生成了2 mol NO解析 根据反应答案 D知,A正确;HNO3在该反应中既表现酸性又表现氧化性,B正确;根据双线桥分析,该反应每生成2 mol NO转移6 mol电子,C正确;HNO3被还原生成NO,若有8 mol HNO3被还原,则生成8 mol NO,D错误。2.回答下列问题。(1)有时在实验室看到的硝酸显黄色,原因是_______________________________。实验室保存硝酸的方法是_______________________________________。(2)铜与足量浓HNO3反应时,表现酸性的硝酸与做氧化剂的HNO3物质的量之比为________。(3)铜粉放入稀硫酸溶液中,加热后无明显变化,但加入某盐一段时间后,发现铜粉质量减少,则该盐不可能是________(填序号)。A.FeCl3 B.NaCl C.KNO3 D.Cu(NO3)2(4)一定量的浓硝酸与足量的铜充分反应,生成气体的成分有________,写出反应的离子方程式:_________________________________________。向反应后的溶液中加入稀硫酸,如果反应,写出反应的离子方程式:_______________________________________________________________________________。(5)从某金属粉末(含有Au、Cu、Ag)中分离出Au,加入的试剂是_______________,写出Ag参与反应的化学方程式:_________________________________________________________________________________________________________________。(6)往两支分别装有浅绿色的Fe(NO3)2和FeSO4溶液的试管中分别逐滴加入稀盐酸时,溶液的颜色变化应该为Fe(NO3)2溶液____________________________________________________;FeSO4溶液________________________________________________________。微思考1.市售浓HNO3为什么呈黄色,如何去除这个黄色?2.浓HNO3反应时,还原产物的价态与什么有关?学习任务1 硝酸的强氧化性资料:资料一、当硝酸与金属反应时,硝酸被还原的程度取决于酸的浓度和还原剂的强弱。对于同一还原剂来说,酸越稀,被还原的程度愈大。资料二、在金属活动性顺序中,位于氢后的金属铜、汞、银等,跟浓硝酸反应时,主要得到二氧化氮;跟稀硝酸反应时,主要得到一氧化氮。所以说,当硝酸与铜、汞、银等金属反应时,浓硝酸比稀硝酸的氧化性强。资料三、当活泼金属锌、镁等跟硝酸反应时,硝酸浓度不同,还原产物不同;前期有气体(NO2)产生,而后期则有铵盐生成。铁与稀硝酸的反应与上述情况类似。上图显示了铁与不同浓度HNO3反应时的还原产物,从上图中可以看出,当其他条件一致时,如温度、还原剂一致时,在浓硝酸(密度为1.35)中,主要产物是NO2,随着HNO3浓度逐渐下降,产物NO2逐渐减少,而一氧化氮的相对含量逐渐增多。当密度是1.30时,主要产物是NO,其次是NO2及少量N2O;当密度是1.15时,NO与NH3的相对含量几乎相当;HNO3的密度为1.05时,NH3成为主要的产物。资料四、Fe、Co、Ni、Al等金属遇到浓硝酸会产生钝化现象。是因为在常温下,浓硝酸跟这些金属接触,能够使金属表面生成一薄层致密的氧化物保护膜阻止内部金属继续跟硝酸反应。结合上述四则资料回答下列问题:1.浓、稀硝酸分别与铜反应时,其还原产物相同吗?提示 浓HNO3、稀HNO3产物不同,前者生成NO2,后者生成NO。2.硝酸的氧化性与浓度有关吗? 越浓氧化性越强,还是越稀氧化性越强?提示 与浓度有关,浓硝酸的氧化性比稀硝酸强。3.实验:在分别盛有少量浓、稀硝酸的试管里,分别滴入几滴紫色石蕊溶液并加热。 请预测实验现象,并给出解释。提示 前者溶液先变成红色,过一会红色消失。后者溶液变成红色,但不消失。这是由于浓硝酸具有强氧化性,而使红色褪去。浓硝酸比稀硝酸氧化性强。硝酸的强氧化性HNO3中的+5价氮元素具有很强的得电子能力。硝酸的浓度越大,反应温度越高,其氧化性越强(1)硝酸与金属的反应①除Au、Pt等少数金属外,硝酸几乎可以氧化所有的金属,如3Ag+4HNO3(稀)===3AgNO3+NO↑+2H2O;③常温下浓硝酸能使Fe、Al钝化。②活泼金属与硝酸反应不生成H2,硝酸的浓度不同,还原产物不同;【例题1】 下列关于硝酸的说法中正确的是( )解析 A项,加热条件下,浓硝酸也能与Fe发生反应;B项,浓、稀硝酸均具有强氧化性;C项,硝酸属于强酸,与浓度大小无关;D项,硝酸的氧化性强弱与其浓度大小有关,浓硝酸的氧化性大于稀硝酸的氧化性,这与HNO3和Cu反应中HNO3得电子数目多少无关。答案 BA.稀硝酸能与Fe发生反应,浓硝酸不能B.浓硝酸和稀硝酸都是强氧化剂C.稀硝酸是弱酸,浓硝酸是强酸D.稀硝酸与Cu反应生成NO,而浓硝酸与Cu反应生成NO2,稀硝酸得电子更多,故稀硝酸的氧化性大于浓硝酸变式训练1 下列反应中硝酸既表现出酸性又表现出氧化性的是(双选)( )A.FeO与稀硝酸反应生成Fe(NO3)和NOB.与铜反应放出NO气体,生成Cu(NO3)2C.与Na2CO3反应放出CO2气体,生成NaNO3D.与S单质混合共热时生成H2SO4和NO2解析 FeO与稀硝酸反应生成Fe(NO3)3,HNO3部分做氧化剂;B项,Cu与稀硝酸反应时,部分起酸的作用生成Cu(NO3)2,部分做氧化剂被还原为NO;C项,2HNO3+Na2CO3===CO2↑+H2O+2NaNO3,HNO3只表现强酸性;D项,HNO3将S氧化为H2SO4,自身被还原为NO2,在该反应中HNO3只表现强氧化性。答案 AB学习任务2 酸雨的形成与防治情景:如图是德国的一座大理石雕像在六十年间的变化,结合所学知识回答下列问题:(1)造成上述现象的原因________________________________________________。(2)写出上述变化中的化学(或离子)方程式:________________________________________________________________________________________________________________________________________________________________。(3)为防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用。请写出燃烧时,有关“固硫”(不使硫化合物进入大气)反应的化学方程式:____________________________________________________________________________________________________________________。1.常见的环境污染2.SO2和氮的氧化物的吸收、转化特别提醒:(1)氮的氧化物是造成酸雨和臭氧层空洞的共同污染物。(2)NO在破坏臭氧层的过程中可发生如下反应:NO+O3―→NO2+O2①NO2+O―→NO+O2②总反应方程式为2O3===3O2,从整个反应来看NO作催化剂。(3)NO使人中毒的原理与CO相似,被人吸入后与血红蛋白结合生成一氧化氮血红蛋白,从而使血红蛋白失去运输O2的能力。【例题2】 下图所示是酸雨的形成示意图。根据图示回答下列问题。(1)下列气体容易形成酸雨的是________。A.CO2 B.SO2 C.N2 D.NO2(2)下列措施中,可减少酸雨产生的途径的是________(填字母)。①少用煤作燃料 ②把工厂烟囱造高 ③燃煤脱硫④在已酸化的土壤中加生石灰 ⑤开发新能源A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤答案 (1)BD (2)C变式训练2 酸雨是对呈酸性(pH小于5.6)降水的统称。下列说法错误的是( )解析 工业废水任意排放引起江河湖泊污染,而酸雨是由于SO2和NO2溶于水引起的。答案 CA.空气中的SO2溶于水,最终形成酸雨B.汽车排放的尾气、硝酸厂和化肥厂的废气都含有氮氧化物C.工业废水任意排放是造成酸雨的主要原因D.为了减少酸雨的形成,必须减少SO2的排放量,对燃料脱硫处理学习任务3 (核心素养)硝酸与金属反应的计算一、知识要点硝酸与金属反应的计算:二、核心素养【素养解题】[典例示范] 物质的量之比为2∶5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )A.1∶4 B.1∶5 C.2∶3 D.2∶5[硝酸与金属反应计算思维模型]答案 A三、对点训练解析 常温下,Al在浓HNO3中钝化,铜与浓HNO3可反应。答案 A1.为除去镀在铝表面的铜镀层,可选用的试剂是( )A.稀硝酸 B.浓硝酸 C.稀硫酸 D.浓盐酸解析 浓硝酸与Cu反应剧烈,所用时间短;因Cu反应后均生成Cu2+,故等质量的Cu失电子数相等,生成n(Cu2+)相等,又溶液体积相同,故c(Cu2+)相等;由电子守恒知Cu→2NO2,3Cu→2NO,故生成气体体积不等。答案 C2.相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应。二者比较,相等的是( )①铜片消耗完所需时间 ②反应生成的气体体积(标准状况) ③反应中氧化剂得到的电子总数 ④反应后溶液中铜离子的浓度A.①③ B.②④ C.③④ D.只有①3.将硝酸表现出的性质填在下列各反应操作或现象后:A.氧化性 B.酸性C.还原性 D.不稳定性(1)久置的浓硝酸变黄色________。(2)用硝酸浸洗附有银的试管________。(3)常温下用铁制或铝制容器贮存、运输浓HNO3__________________。(4)用稀HNO3浸洗久置石灰水试剂瓶上的固体________________。(5)用Cu和稀HNO3制NO气体________。(6)浓HNO3中滴入石蕊溶液并微热,石蕊溶液先变红后褪色________。解析 浓HNO3见光或受热易分解生成NO2,NO2又溶于硝酸中而使其显黄色。浓硝酸具有强氧化性,常温下使Fe、Al金属钝化,与金属Cu、Ag等都能发生反应。硝酸具有酸性,与碱、盐、碱性氧化物等反应。在浓HNO3中滴入石蕊溶液,石蕊溶液先变红,表现出酸性,后褪色,又表现出强氧化性。答案 (1)D (2)AB (3)A (4)B (5)AB (6)AB4.为研究硝酸的性质,某同学设计并完成如下实验:室温下,将铁片分别置于适量的稀HNO3和浓HNO3中(如图所示)。(1)气球的作用是___________________________________________。(2)A中溶液最终变为浅绿色,发生反应的离子方程式是_________________________________________________________________。(3)B中无明显变化,该同学进一步探究如下:假设①常温下铁与浓硝酸不反应。②________________________________________________________________________________________________________________________________。进行实验:将B中的铁片取出并洗净后,放入CuSO4溶液中,无明显变化,则说明假设①________(填“成立”或“不成立”)。
人教版 (2019)必修 第二册第二节 氮及其化合物课堂教学课件ppt: 这是一份人教版 (2019)必修 第二册第二节 氮及其化合物课堂教学课件ppt,共20页。PPT课件主要包含了强氧化性,什么是酸雨呢,酸雨是怎样形成的呢,催化剂,硫酸型酸雨,硝酸型酸雨等内容,欢迎下载使用。
人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第二节 氮及其化合物教学课件ppt: 这是一份人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素第二节 氮及其化合物教学课件ppt,共53页。PPT课件主要包含了课前·新知导学,有刺激性,阴凉处,致密的氧化物,浓盐酸,煤和石油,高温条件,氮气和,呼吸道,小于56等内容,欢迎下载使用。
人教版 (2019)必修 第二册第二节 氮及其化合物课文内容ppt课件: 这是一份人教版 (2019)必修 第二册第二节 氮及其化合物课文内容ppt课件,共24页。PPT课件主要包含了无色液体,有刺激性气味,易挥发,二化学性质,不稳定性,变黄的浓硝酸,强氧化性,有大量气泡产生,无色变为蓝色,红棕色等内容,欢迎下载使用。













