

人教版 (2019)必修 第二册实验活动4 用化学沉淀法去除粗盐中的杂质离子同步训练题
展开
这是一份人教版 (2019)必修 第二册实验活动4 用化学沉淀法去除粗盐中的杂质离子同步训练题,共7页。试卷主要包含了选择题的作答,非选择题的作答,下列说法不正确的是,铝热反应的实验装置如图等内容,欢迎下载使用。
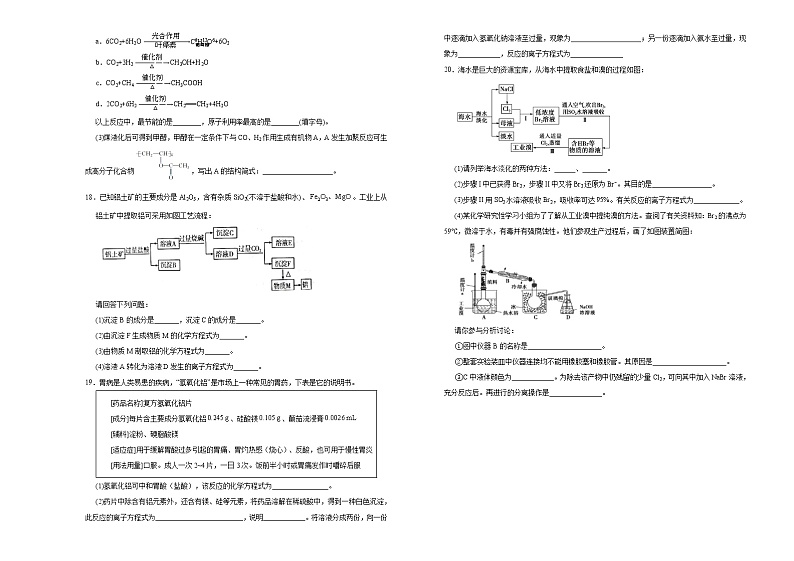
2020-2021学年高一下学期第八单元达标检测卷化 学(B)注意事项:1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。4.考试结束后,请将本试题卷和答题卡一并上交。可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 S 32 Cl 35.5 K 39 Cu 64 一、选择题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。)1.市场上出售的紫葡萄,表皮上常附着一些浅蓝色的斑点,它是为防治霉菌而喷洒的农药波尔多液。波尔多液中含有一种有毒的盐,因此在吃葡萄之前,应将葡萄浸泡在水中一段时间。这种有毒的盐是A.氯化钡 B.硫酸铜 C.硝酸银 D.碳酸钠2.2020年10月,第五届模拟气候变化大会在清华大学成功举办,气候变化带来的环境问题是人类面临的最大威胁,下列有关环境的说法中正确的是A.草木灰中钾肥含量高,可以通过焚烧秸秆增加土壤肥效B.“爆竹声中一岁除,春风送暖人屠苏”,应把节日燃放烟花的传统发扬光大C.“雾霾天气”“温室效应”“光化学烟雾”“PM2.5”等都与汽车尾气排放有关D.绿色化学的核心是应用化学原理对环境污染进行治理3.在冶金工业上,均能用化学还原剂制得的一组金属是A.Zn、Fe、Cu B.Na、Zn、Fe C.Na、Mg、Al D.Mg、Zn、Fe4.食品安全和化学科学密切相关,下列说法不正确的是A.可用聚乙烯制作食品包装袋B.瘦肉精可提高生猪的瘦肉量,我们应向养猪厂家大力推广C.食用过量发色剂(主要成分为NaNO2)会引起人体中毒D.绿色食品的生产须以生态环境较佳的地域为基地,并采用绿色生产技术和工艺5.下列说法不正确的是A.废旧金属的回收再利用,有利于环境保护B.金属活动性不同,冶炼方法也有所不同C.地球上金属矿物资源是有限的,因此,应提高金属矿物的利用率D.从自然界中获得金属单质均需要通过化学方法6.铝热反应的实验装置如图。下列有关铝热反应的说法中,不正确的是A.工业上可以利用铝热反应的方法冶炼金属镁B.铝热反应可用于冶炼某些高熔点金属C.铝热反应体现了铝的还原性D.实验现象为火星四溅,漏斗下方有红热熔融物流出7.下列有关环境保护的叙述不正确的是A.形成酸雨的主要物质是硫的氧化物和氮的氧化物B.大气污染物主要来自化石燃料燃烧和工业生产过程中产生的废气C.农田秸秆直接焚烧既省时又省力,应大力推广D.燃煤烟气脱硫的石灰石—石膏法,可将烟气中的二氧化硫转化为硫酸钙8.“绿色化学”是21世纪化学发展的主导方向。“绿色化学”的要求是从根本上消灭污染,是一门能彻底阻止污染产生的科学,它包括“绿色生成”和“绿色销毁”等内容。在整顿音像市场的活动中,查封了一批盗版光盘,并进行了“绿色销毁”。以下属于“绿色销毁”的是A.泼上汽油焚烧 B.倾倒于江河之中C.深埋于土中 D.碾压粉碎后回收利用9.非结合胆红素(VCB)分子有还原性,被氧化后与钙离子结合生成胆红素钙,形成胆结石。下列方法能预防胆结石的方法是A.适量服用维生素 E、维生素 C 等抗氧化自由基可防治胆结石B.不食用含钙的食品C.大量食用纯碱可使钙离子沉淀完全,防止胆结石生成D.常喝水稀释钙离子,溶解沉淀10.海洋植物如海带、海藻中含有丰富的碘元素。如图为从海带中提取碘的工业生产过程,有关说法错误的是A.生产过程中通常将干海带粉碎的目的是增大海带与水的接触面积B.干海带浸泡液中的碘离子可用淀粉溶液检验C.工业上不直接从海水提取碘的原因是海水中碘的浓度很低D.从海带中提碘的过程有利用了氧化还原反应原理二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。11.下列说法中错误的是A.煤经过气化和液化等物理变化可转化为清洁燃料B.石油的分馏是物理变化,可得到汽油、煤油、柴油等燃料C.与煤、石油相比较,天然气是一种比较清洁的化石燃料D.乙醇是一种可再生能源,其优点是完全燃烧的产物不污染环境12.溴是海水中的重要元素,海水中溴元素的含量一般为0.067g/L,晒盐浓缩后的苦卤中含有浓度较高的溴离子,向苦卤中通入氯气,可以得到单质溴。下列有关说法正确的是A.向苦卤中通入氯气发生反应的离子方程式为Br−+Cl2==Cl−+Br2B.向苦卤中通入氯气时,溴元素化合价升高,被还原C.将单质溴从溴水中分离出来,可以利用裂化汽油进行萃取D.将单质溴从溴水中分离出来,可以利用苯、四氯化碳等多种有机溶剂进行萃取13.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,通过乙醇制取氢气具有良好的应用前景。已知通过乙醇制取氢气有如下两条路线:a.水蒸气催化重整:CH3CH2OH(g)+H2O(g)―→4H2(g)+2CO(g) 1mol乙醇反应吸收255.58kJ能量b.部分催化氧化:CH3CH2OH (g)+O2(g)―→3H2(g)+2CO(g) 1mol乙醇反应吸收13.76kJ能量则下列说法错误的是A.从原料消耗的角度来看,a路线制氢更有价值B.从能量消耗的角度来看,a路线制氢更加有利C.降低温度,可提高b路线中乙醇的反应速率D.a路线制氢由于要消耗很多能量,所以在实际生产中意义不大14.某工厂用提取粗盐后的盐卤(主要成分为MgCl2)制备金属镁,其工艺流程图如下所示:下列说法错误的是A.若在实验室进行操作①,只需要漏斗和烧杯两种玻璃仪器B.加入足量的石灰浆发生的反应为非氧化还原反应C.操作②是蒸发浓缩、冷却结晶D.在整个制备过程中,未发生置换反应15.下列有关物质的工业制法中,正确的是A.制钠:以海水为原料制得精盐,再电解熔融的NaClB.炼铜:电解精炼黄铜矿得到纯度为99.9%的铜C.制硅:用一氧化碳还原二氧化硅得硅D.制铝:电解液态氯化铝得铝三、非选择题:本题共5小题,共60分16.如图是两种化肥标签的一部分,请回答:(1)从标签上看,两种化肥具有的共同物理性质之一是____________________;碳酸氢铵不同于尿素的化学性质是____________________。 (2)这种尿素和碳酸氢铵的含氮的质量分数之比为________。 (3)从含氮量角度,50kg这种碳酸氢铵相当于_____kg(精确到0.1)这种尿素。 17.2017年初,我国北方大部分地区出现了严重的空气污染,其主要原因是化石燃料的大量使用。提高燃料利用率,减少化石燃料的燃烧造成的环境污染,已成为人类面临的重大挑战。(1)氢气是人类理想的能源,为了有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发且比较经济的制氢气的方法是________(填序号)。①电解水 ②锌与稀硫酸反应 ③光解海水制得氢气后还需要解决的问题是________(写出其中一个)。(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:a.6CO2+6H2O+6O2b.CO2+3H2CH3OH+H2Oc.CO2+CH4CH3COOHd.2CO2+6H2CH2===CH2+4H2O以上反应中,最节能的是________,原子利用率最高的是________(填字母)。(3)煤液化后可得到甲醇,甲醇在一定条件下与CO、H2作用生成有机物A,A发生加聚反应可生成高分子化合物,写出A的结构简式:____________________。18.已知铝土矿的主要成分是Al2O3,含有杂质SiO2(不溶于盐酸和水)、。工业上从铝土矿中提取铝可采用如图工艺流程:请回答下列问题:(1)沉淀B的成分是_______,沉淀C的成分是_______。(2)由沉淀F生成物质M的化学方程式为_______。(3)由物质M制取铝的化学方程式为_______。(4)溶液A转化为溶液D发生的离子方程式为_______。19.胃病是人类易患的疾病,“氢氧化铝”是市场上一种常见的胃药,下表是它的说明书。[药品名称]复方氢氧化铝片[成分]每片含主要成分氢氧化铝、硅酸镁、颠茄流浸膏[辅料]淀粉、硬脂酸镁[适应症]用于缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸,也可用于慢性胃炎[用法用量]口服。成人一次2~4片,一日3次。饭前半小时或胃痛发作时嚼碎后服(1)氢氧化铝可中和胃酸(盐酸),该反应的化学方程式为________________。(2)药片中除含有铝元素外,还含有镁、硅等元素,将药品溶解在稀硫酸中,得到一种白色沉淀,此反应的离子方程式为_________________________,说明____________。将溶液分成两份,向一份中逐滴加入氢氧化钠溶液至过量,现象为____________________;另一份逐滴加入氨水至过量,现象为____________,反应的离子方程式为_______________20.海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图:(1)请列举海水淡化的两种方法:______、_______。(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br−。其目的是_________________。(3)步骤II用SO2水溶液吸收Br2,吸收率可达95%。有关反应的离子方程式为_____________。(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法。查阅了有关资料知:Br2的沸点为59℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如图装置简图:请你参与分析讨论:①图中仪器B的名称是_____________________。②整套实验装皿中仪器连接均不能用橡胶塞和橡胶管。其原因是_____________________。③C中液体颜色为____________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后。再进行的分离操作是_______________。
2020-2021学年高一下学期第八单元达标检测卷化学答案(B)1.【答案】B【解析】根据题目信息“表皮上常附着一些浅蓝色的斑点”结合题目选项,应选择硫酸铜,选B。2.【答案】C【解析】A.焚烧秸秆,会产生大量烟雾,对空气造成污染,给环境造成巨大影响,严重影响到人们的日常生活,故A错误;B.爆竹爆炸会污染空气和产生纸屑,污染环境,故B错误;C.光化学烟雾主要是由汽车排放的尾气中氮的氧化物造成的;汽车尾气是主要的污染物排放源,近年来城市的汽车越来越多,排放的汽车尾气是产生雾霾的一个因素,故C正确;D.绿色化学的核心是从源头上减少对环境的污染,所以不能产生污染后再利用化学原理对环境污染进行治理,故D错误;答案选C。3.【答案】A【解析】根据金属活动性顺序有下列冶炼方法:①K~Al,用电解法;②Zn~Cu用还原剂(如H2,CO等)还原法;③Hg和Ag用加热分解法。答案选A。4.【答案】B【解析】聚乙烯无毒,可用于制作食品包装袋,故A项说法正确;“瘦肉精”能诱发恶性肿瘤,对人体有危害,养猪场应禁止使用,故B项说法错误;亚硝酸钠含量超标会危害人体健康,可能致癌,故C项说法正确;绿色食品是指在良好的生态环境中,通过无污染的生产过程生产出的安全营养、无公害的食品,故D项说法正确。5.【答案】D【解析】A.金属矿物资源是有限的,要回收再利用废旧金属,A项正确;B.金属活动性不同,金属阳离子被还原的难易程度不同,冶炼方法不同,B项正确;C.金属矿物资源是有限的,因此,应提高金属矿物的利用率,C项正确;D.自然界中的绝大多数金属元素以化合态形式存在,这些金属单质的获得需要通过化学方法,极少数金属元素如Au、Pt等以游离态形式存在,这些金属单质的获得只需要通过物理方法(如富集法),D项错误;答案选D。6.【答案】A【解析】铝的金属活泼性弱于镁,则不可用铝热反应制取镁,工业上常用电解熔融氯化镁的方法制取镁,A错误;铝的还原性强,且铝热反应放出大量的热,可以通过铝热反应冶炼某些高熔点金属,B正确;金属铝和金属氧化物之间反应可以用于高熔点金属的冶炼,铝热反应体现了金属铝的还原性,C正确;铝热反应的实验现象为反应剧烈,火星四溅,漏斗下方有红热熔融物流出,D正确。7.【答案】C【解析】A.形成酸雨的主要物质是SO2、NO2、NO等,A正确;B.化石燃料燃烧的废气主要是硫的氧化物和氮氧化物,造成大气污染,B正确;C.农田秸秆直接焚烧会造成空气污染,C错误;D.燃煤烟气脱硫的石灰石—石膏法,先发生CaCO3=CaO+CO2,再发生2SO2+2CaO+O2=2CaSO3,D正确;故选C。8.【答案】D【解析】光盘的材质是塑料,B、C中的措施会造成白色污染;A项中措施会释放大量有害气体,均不符合绿色化学的理念;D项中措施既可减少污染,又能节约资源。9.【答案】A【解析】A.低维生素E、低维生素C等抗氧化自由基有还原性,能防止羟基(-OH)被氧化后生成羧基,可以防止胆结石,选项A正确;B.不食用含钙的食品,会导致人体缺钙,选项B错误;C.纯碱能与钙离子反应,形成沉淀,选项C错误;D.人体的体液平衡需维持一定浓度的钙离子,且碳酸钙等沉淀难溶于水,选项D错误;答案选A。10.【答案】B【解析】A.干海带粉碎的目的是增加海带与水的接触面积,有利于海带中的碘化物充分溶于水中,A说法正确;B.淀粉遇到碘单质变蓝,与碘离子不发生颜色反应,所以不能用淀粉检验碘离子,B说法错误;C.海水中的碘化物的浓度很低,不能直接提取,应浓缩后再提取,C说法正确;D.碘离子转化为碘单质的反应属于氧化还原反应,D说法正确;故选B。11.【答案】A【解析】A.煤的气化和液化等过程中均有新物质产生,因此均是化学变化,A错误;B.石油的分馏过程中没有产生新物质,属于物理变化,石油的分馏可得到汽油、煤油、柴油等燃料,B正确;C.天然气的主要成分是甲烷,完全燃烧产生二氧化碳和水,因此与煤、石油相比较,天然气是一种比较清洁的化石燃料,C正确;D.乙醇是一种可再生能源,完全燃烧产生二氧化碳和水,因此其优点是完全燃烧的产物不污染环境,D正确;答案选A。12.【答案】D【解析】A项,离子方程式未配平,错误;B项,向苦卤中通入氯气时,溴元素化合价升高,被氧化,错误;C项,裂化汽油中含有大量不饱和烃,会与溴发生加成反应,因此不能用作溴的萃取剂,错误;D项,Br2在苯、CCl4中溶解度很大,且不与之发生反应,苯、CCl4与水不互溶,因此可用苯、CCl4等萃取溴水中的溴,正确。 13.【答案】BC【解析】相同质量的乙醇,a路线生成的氢气多;b路线需要的能量远远小于a路线;降低温度,反应速率减小。14.【答案】A【解析】A.操作①是过滤,所需玻璃仪器除了漏斗和烧杯,还有玻璃棒,A错误;B.加入足量的石灰浆目的是与溶液中的Mg2+发生复分解反应产生Mg(OH)2沉淀,反应过程中元素化合价不变,因此属于非氧化还原反应,B正确;C.从MgCl2溶液中得到含结晶水的MgCl2·6H2O晶体,操作方法是蒸发浓缩、冷却结晶,C正确;D.在整个制备过程中,发生的反应类型有复分解反应、氧化还原反应、分解反应,未发生置换反应,D正确;故合理选项是A。15.【答案】A【解析】A.海水中含有大量NaCl,粗盐经提纯后得到精盐,电解熔融NaCl:2NaCl2Na+Cl2↑,得到金属钠,故A正确;B.黄铜矿(主要成分为CuFeS2)经过冶炼后得到粗铜,粗铜进行电解经电解精炼得到99.9%的铜,故B错误;C.一氧化碳还原二氧化硅得到粗硅,粗硅再与氯气反应得到SiCl4,再与氢气反应得到纯硅,故C错误;D.氯化铝为共价化合物,液态氯化铝不导电,无法电解,故D错误;综上所述答案为A。16.【答案】(1)可(或易)溶于水 受热易分解(2)23∶8(3)17.4【解析】(1)根据化肥标签中的内容可知,避免雨天施用、防潮,说明两种化肥可(或易)溶于水;NH4HCO3放于阴暗处,避免高温天气施用,说明NH4HCO3受热易分解。(2)46.0%∶16.0%=23∶8。(3)只要两种氮肥含氮元素质量相等即可。50kg×16.0%=m×46.0%,m≈17.4kg。17.【答案】(1)③ 贮存和运输(写出一个即可)(2)a c(3)【解析】(1)①②都不符合经济原则,③既可开发又较经济。制得氢气后需要解决的问题是贮存和运输。(2)节能中的“能”指人类提供的能量。利用太阳能是最节能的措施之一,而光合作用就是充分利用太阳能;原子利用率最高的化学反应是产物只有一种的化合反应、加成反应、加聚反应等。a利用太阳能,最节能;c中无副产物,原子利用率最高。(3)由高分子化合物的结构可推知A的结构简式为。18.【答案】(1)SiO2 Mg(OH)2和Fe(OH)3 (2)2Al(OH)3Al2O3+3H2O (3)2Al2O3(熔融)4Al+3O2↑ (4)Al3++4OH−=AlO+2H2O 【解析】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO,因Al2O3、SiO2与NaOH溶液反应,MgO、Fe2O3不与NaOH溶液反应;除SiO2不与盐酸反应外,Al2O3、Fe2O3、MgO均与盐酸反应;结合流程可知,加入过量盐酸,溶液A为AlCl3、MgCl2、FeCl3,沉淀B为SiO2,A中加入过量烧碱,沉淀C为Fe(OH)3和Mg(OH)2,溶液D为NaAlO2,D中通入过量二氧化碳,溶液E为NaHCO3,沉淀F为Al(OH)3,加热分解得到M为Al2O3,经电解氧化铝可得到Al。(1)由上述分析可知,沉淀B的成分是SiO2,沉淀C为Mg(OH)2和Fe(OH)3,故答案为:SiO2;Mg(OH)2和Fe(OH)3,(2)沉淀F转化为物质M的化学方程式为2Al(OH)3Al2O3+3H2O,故答案为:2Al(OH)3Al2O3+3H2O;(3)由物质M制取铝的化学方程式为2Al2O3(熔融)4Al+3O2↑,故答案为:2Al2O3(熔融)4Al+3O2↑;(4)由上述分析可知,溶液A转化为溶液D发生的离子方程式为Al3++4OH−=AlO+2H2O,故答案为:Al3++4OH−=AlO+2H2O。19.【答案】(1)Al(OH)3+3HCl=AlCl3+3H2O (2)MgSiO3+2H+=H2SiO3↓+Mg2+ 硫酸的酸性比硅酸的强 先有白色沉淀产生且逐渐增多,后沉淀又逐渐减少到一定量后不再减少 有白色沉淀产生且逐渐增多至一定量后不再改变 Mg2++2NH3∙H2O=Mg(OH)2↓+2NH,Al3++3NH3∙H2O=Al(OH)3↓+3NH 【解析】(1)氢氧化铝可与盐酸反应生成氯化铝和水,反应的方程式为Al(OH)3+3HCl=AlCl3+3H2O;(2)硅酸镁与硫酸反应生成白色沉淀硅酸,离子方程式为MgSiO3+2H+=H2SiO3↓+Mg2+;根据强酸制弱酸原理,说明硫酸的酸性比硅酸的强;硫酸铝、硫酸镁能与NaOH反应生成氢氧化铝、氢氧化镁,随NaOH的加入,溶液中铝离子、镁离子反应完全时,氢氧化铝与NaOH反应生成偏铝酸钠溶液,可观察到先有白色沉淀产生且逐渐增多,后沉淀又逐渐减少到一定量后不再减少;而氨水不能与氢氧化铝反应,则加入氨水至过量时,可观察到有白色沉淀产生且逐渐增多至一定量后不再改变;反应的离子方程式为Mg2++2NH3∙H2O=Mg(OH)2↓+2NH,Al3++3NH3∙H2O=Al(OH)3↓+3NH。20.【答案】(1)蒸馏法 电渗析法 (2)富集溴元素 (3)Br2+SO2+2H2O=4H++SO+2Br− (4)直形冷凝管 Br2腐蚀橡胶 深红棕色 萃取、分液 【解析】由流程可知,海水淡化常见的方法主要有蒸馏法、电渗析法、离子交换法,分离出NaCl,电解饱和食盐水为氯碱工业,氯碱工业得到的氯气与母液中溴离子反应生成低浓度的Br2溶液,此时蒸馏会消耗大量能源,成本较高,因此用热空气吹出,用二氧化硫水溶液吸收得到硫酸和氢溴酸,再用氯气氧化氢溴酸,得到较大浓度的Br2溶液,再蒸馏得到Br2,蒸馏时要注意Br2的沸点为59℃,微溶于水,有毒并有强腐蚀性,因此控制好温度,整个过程中不能使用橡皮管。(1)海水淡化的方法有:蒸馏法、电渗析法等,故答案为:蒸馏法;电渗析法;(2)步骤Ⅰ中已获得Br2,获得的Br2浓度较小,因此步骤Ⅱ中又将Br2还原为Br−,其目的是富集溴元素,故答案为:富集溴元素;(3)步骤Ⅱ用SO2水溶液吸收Br2生成HBr和硫酸,反应的离子方程式为Br2+SO2+2H2O=4H++SO+2Br−,故答案为:Br2+SO2+2H2O=4H++SO+2Br−;(4)①图中仪器B的名称是:直形冷凝管,故答案为:直形冷凝管;②控制温度59℃,使溴单质挥发,通过冷凝得到呈深红棕色的液态溴单质,同时避免污染环境,最后进行尾气吸收,由于溴单质是一种强氧化剂,易腐蚀橡胶制品,所以整套装置不能用橡胶塞和橡胶管,故答案为:Br2腐蚀橡胶;③C中收集到液态的Br2,常温下,Br2为深红棕色液体,Cl2和NaBr溶液反应得Br2和NaCl混合溶液,从而除去Cl2,再经萃取、分液去掉水层得Br2的有机溶液,故答案为:深红棕色;萃取、分液。
相关试卷
这是一份高中化学必修2 第七单元有机化合物达标检测卷 新B) 学生版,共7页。
这是一份高中化学必修2 第六单元化学反应与能量达标检测卷 新B) 学生版,共7页。
这是一份高中化学必修2 第六单元化学反应与能量达标检测卷 新A) 学生版,共7页。










