
高中化学人教版 (2019)选择性必修1实验活动3 盐类水解的应用课时作业
展开
第三章 水溶液中的离子反应与平衡
第三节 盐类的水解
第2课时 教学设计
【教学目标】
1.会分析外界条件对盐类水解平衡的影响。
2.了解盐类水解在生产生活、科学研究中的应用。
3.掌握溶液中离子浓度大小的比较方法。
【教学重难点】
影响盐类水解的因素、溶液中粒子浓度大小比较、盐类水解的应用
【教学过程】
1.新课导入
[创设情境]人们利用水解反应设计出了泡沫灭火器。泡沫灭火器中装有浓NaHCO3溶液和浓Al2(SO4)3溶液,当二者混合时发生剧烈的反应,产生气体和沉淀,在起泡剂作用下迅速产生大量泡沫,用以灭火。浓NaHCO3溶液和浓Al2(SO4)3溶液混合后为什么会发生剧烈的反应?生成的气体和沉淀分别是什么?你能运用有关盐类水解反应的知识进行分析吗?
[生]HCO3-水解生成CO2和OH-,Al3+水解生成Al(OH)3和H+,浓NaHCO3溶液和浓Al2(SO4)3溶液混合后,促进HCO3-和Al3+双水解。
[过渡]这是我们利用盐类水解的相关知识应用到实际成产和生活中。盐类的水解过程是可逆的,和我们之前学习的化学平衡及电离平衡一样,盐类的水解存在平衡,那么影响盐类水解平衡的因素有哪些?这是我们本节课要学习的内容。
2.新课讲授
[板书]一、盐的水解平衡常数
[讲解]以强碱弱酸盐(MA)为例,其水解的离子方程式为,盐的水解常数为。
[学生活动]写出HA的电离常数,观察强碱弱酸盐的水解常数与弱酸的电离常数的关系。
[设疑]你认为影响盐类水解的主要因素可能有哪些?
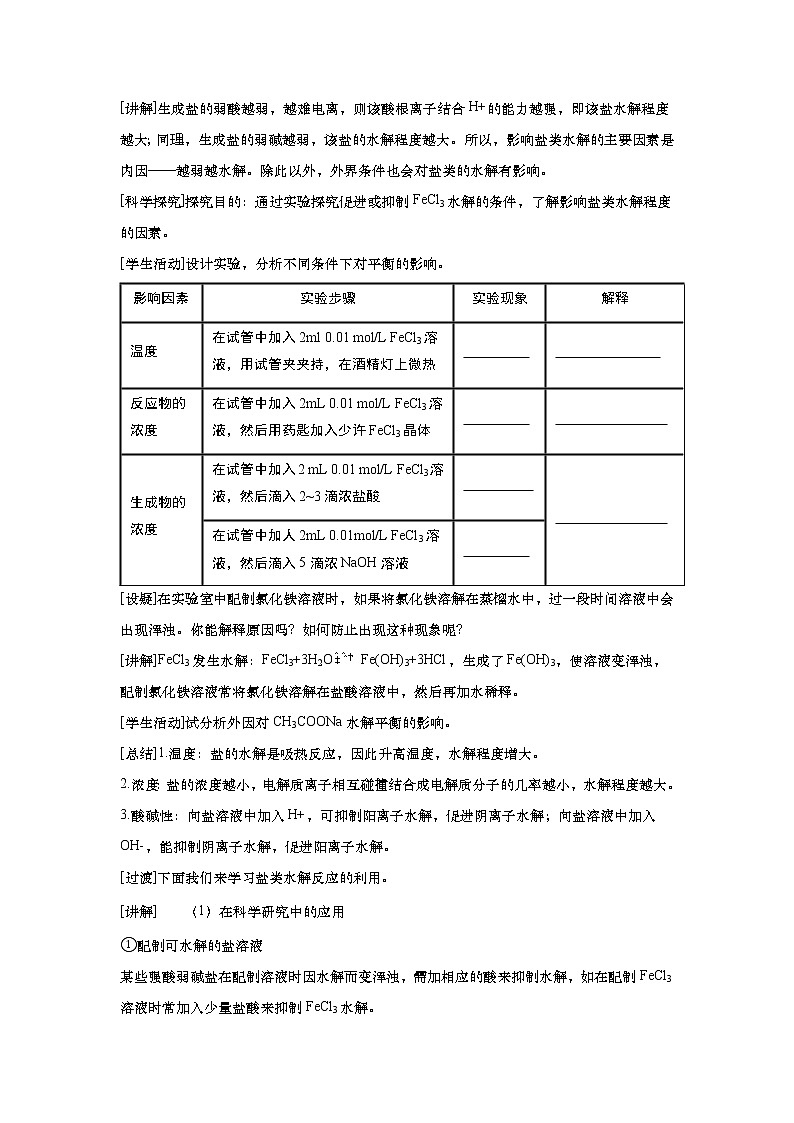
[讲解]生成盐的弱酸越弱,越难电离,则该酸根离子结合H+的能力越强,即该盐水解程度越大;同理,生成盐的弱碱越弱,该盐的水解程度越大。所以,影响盐类水解的主要因素是内因——越弱越水解。除此以外,外界条件也会对盐类的水解有影响。
[科学探究]探究目的:通过实验探究促进或抑制FeCl3水解的条件,了解影响盐类水解程度的因素。
[学生活动]设计实验,分析不同条件下对平衡的影响。
影响因素 | 实验步骤 | 实验现象 | 解释 |
温度 | 在试管中加入2ml 0.01 mol/L FeCl3溶液,用试管夹夹持,在酒精灯上微热 |
|
|
反应物的浓度 | 在试管中加入2mL 0.01 mol/L FeCl3溶液,然后用药匙加入少许FeCl3晶体 |
|
|
生成物的浓度 | 在试管中加入2 mL 0.01 mol/L FeCl3溶液,然后滴入2~3滴浓盐酸 |
|
|
在试管中加人2mL 0.01mol/L FeCl3溶液,然后滴入5滴浓NaOH溶液 |
|
[设疑]在实验室中配制氯化铁溶液时,如果将氯化铁溶解在蒸馏水中,过一段时间溶液中会出现浑浊。你能解释原因吗?如何防止出现这种现象呢?
[讲解]FeCl3发生水解:FeCl3+3H2OFe(OH)3+3HCl,生成了Fe(OH)3,使溶液变浑浊,配制氯化铁溶液常将氯化铁溶解在盐酸溶液中,然后再加水稀释。
[学生活动]试分析外因对CH3COONa水解平衡的影响。
[总结]1.温度:盐的水解是吸热反应,因此升高温度,水解程度增大。
2.浓度:盐的浓度越小,电解质离子相互碰撞结合成电解质分子的几率越小,水解程度越大。
3.酸碱性:向盐溶液中加入H+,可抑制阳离子水解,促进阴离子水解;向盐溶液中加入OH-,能抑制阴离子水解,促进阳离子水解。
[过渡]下面我们来学习盐类水解反应的利用。
[讲解](1)在科学研究中的应用
①配制可水解的盐溶液
某些强酸弱碱盐在配制溶液时因水解而变浑浊,需加相应的酸来抑制水解,如在配制FeCl3溶液时常加入少量盐酸来抑制FeCl3水解。
②可水解盐溶液的储存
某些强碱弱酸盐水解呈碱性,用玻璃试剂瓶贮存时,不能用玻璃塞。如Na2CO3 溶液、NaF溶液等不能贮存于磨口玻璃瓶中。
③判断加热浓缩某些盐溶液的产物
如加热浓缩FeCl3溶液,FeCl3水解生成Fe(OH)3和HCl,由于盐酸易挥发使水解平衡向右移动,蒸干后得到的物质为Fe(OH)3。
④制备胶体
将饱和FeCl3溶液滴入沸水中因水解而得到红褐色Fe(OH)3胶体。
⑤判断溶液的酸碱性
Na2CO3溶液呈碱性的原因: 。
⑥判断盐溶液中粒子的种类及浓度的大小如Na2CO3;溶液中存在的粒子有 。
⑦判断离子能否共存
若阴、阳离子发生水解相互促进的反应,水解程度较大而不能大量共存,有的甚至水解完全。常见的水解相互促进的反应进行完全的有Al3+、Fe3+与CO32-、HCO3-、AlO2-等。
(2)日常生活中的应用
①热的纯碱液去油污效果更好
纯碱(Na2CO3)水解呈碱性,加热能促进水解,溶液的碱性增强,热的纯碱溶液去污效果增强。水解的离子方程式为。
②明矾(铝盐)用作净水剂
明矾溶于水电离产生的Al3+水解,生成Al(OH)3胶体表面积大,吸附水中悬浮的杂质而使水变澄清。有关的离子方程式是。
③泡沫灭火剂
泡沫灭火器内所盛装药品分别是NaHCO3溶液和Al2(SO4)3溶液,在使用时将两者混合,铝离子的水解会促进碳酸氢根离子的水解,从而使水解完全,产生CO2和Al(OH)3。离子方程式。
④铵态氮肥不能与草木灰混合使用
草木灰的成分:K2CO3,铵态氮肥——铵盐。
因为NH4+在水溶液中能发生水解生成H+,CO32-在水溶液中水解产生OH-,当二者同时存在时,则二者水解产生的H+和OH-能发生中和反应,使水解程度都增大,铵盐水解产生的NH3•H2O易挥发而降低了肥效。
[补充]电解质溶液中的三个守恒及溶液中粒子浓度大小的比较相关知识。
3.课堂小结
[师]本节课需掌握影响盐类水解的因素及盐类水解的应用。
4.板书
3.3.1盐类的水解
苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第三单元 盐类的水解精练: 这是一份苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第三单元 盐类的水解精练,共26页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡优秀同步训练题: 这是一份高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡优秀同步训练题,共12页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第三单元 盐类的水解练习: 这是一份苏教版 (2019)选择性必修1第三单元 盐类的水解练习,文件包含332影响盐类水解的因素作业解析版docx、332影响盐类水解的因素作业原卷版docx等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。













