



高中化学选择性必修二 1.2.2 元素周期律(备课件)同步备课系列
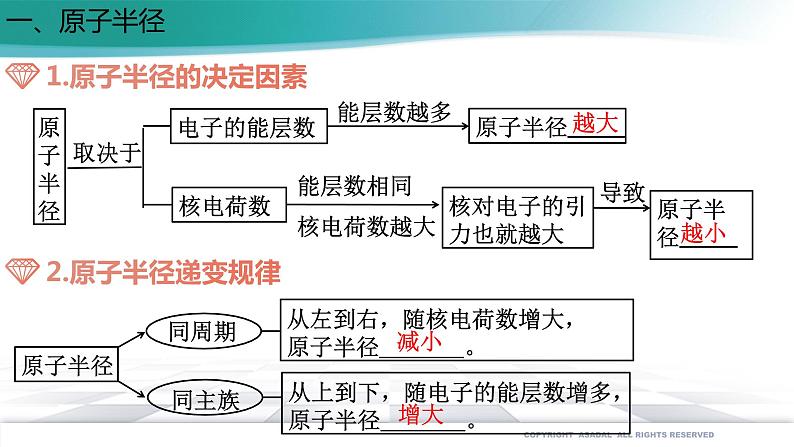
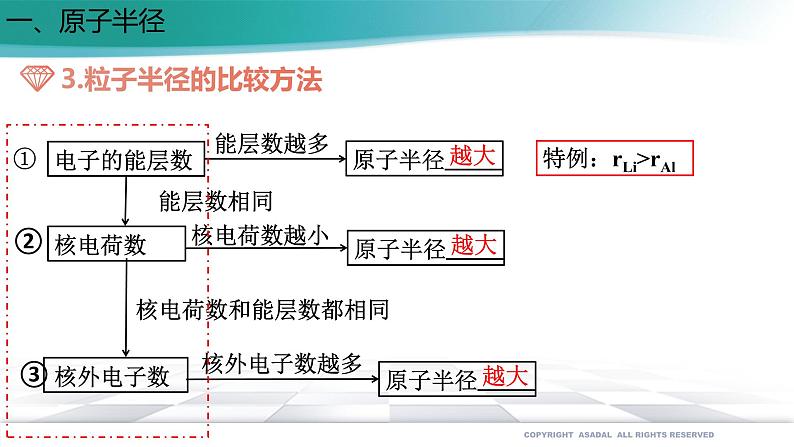
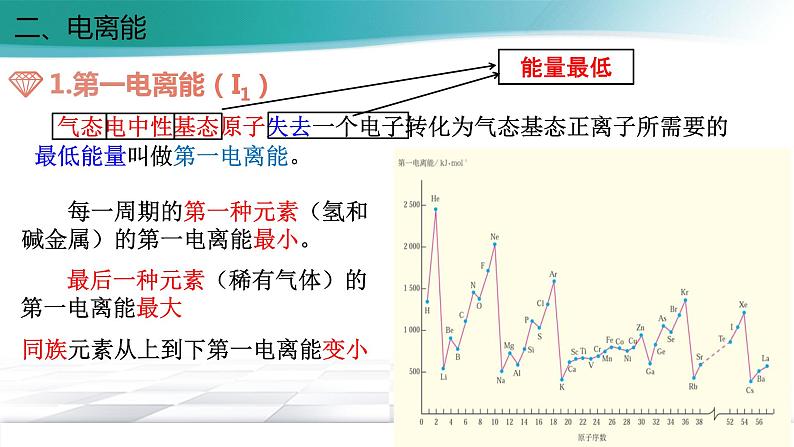
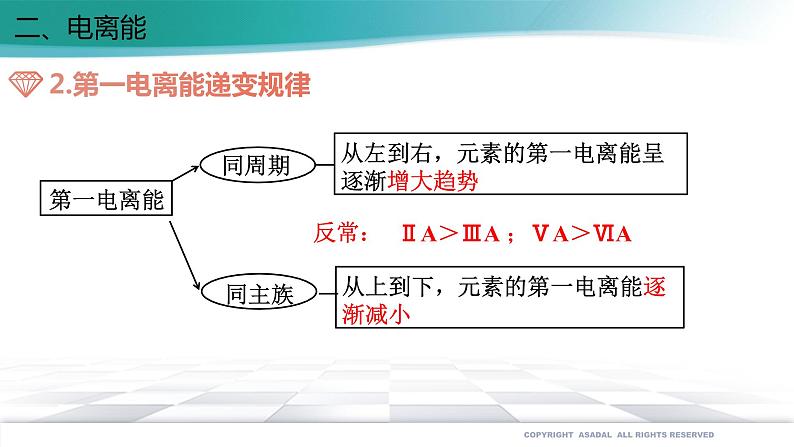
展开第一章 原子结构与性质 第二节 原子结构与元素的性质第二课时一、原子半径原子半径的大小取决于两个相反的因素:(1)电子的能层数(2)核电荷数 电子的能层越多,电子之间的排斥作用将原子的半径增大。 核电荷数越大,核对电子的吸引作用也越大,将原子的半径减小。 这两个因素综合的结果使原子半径呈现周期性的递变一、原子半径减小增大取决于越大能层数越多能层数相同核电荷数越大导致越小越大能层数越多能层数相同越大核电荷数越小①②越大核外电子数越多核电荷数和能层数都相同③一、原子半径二、电离能 气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量叫做第一电离能。 每一周期的第一种元素(氢和碱金属)的第一电离能最小。 最后一种元素(稀有气体)的第一电离能最大同族元素从上到下第一电离能变小能量最低二、电离能ⅡA>ⅢA ;ⅤA>ⅥA反常:二、电离能为什么B、Al、O、 S等元素的电离能比它们左边元素的电离能低? 原因是B失去的电子是2p电子,2p电子的轨道能比2s电子的轨道能高;同理,Al的第一电离能比Mg的第一电离能小; 原因是氧的第一电离能是失去已经成对的2p电子所需能量,成对电子的相互排斥的能量比核电荷增加吸引2p电子的能量还大,导致氧的第一电离能反比氮的第一电离能低;另外,氮的电子排布是半充满的,比较稳定。同理,硫的第一电离能反而小于磷的第一电离能。为什么B的第一电离能反而比Be小?氧的第一电离能为什么反而比氮的第一电离能小?由于原子失去电子形成离子后,若再失去电子会更加困难,因此同一原子的各级电离能之间存在如下关系:I1
高中化学选择性必修二 1.2.2 元素周期律课件下学期(共19张): 这是一份高中化学选择性必修二 1.2.2 元素周期律课件下学期(共19张),共19页。
高中化学选择性必修二 1.2.2 元素周期律(原卷版)同步备课系列: 这是一份高中化学选择性必修二 1.2.2 元素周期律(原卷版)同步备课系列,共8页。
高中化学选择性必修二 1.2.2 元素周期律(解析版)同步备课系列: 这是一份高中化学选择性必修二 1.2.2 元素周期律(解析版)同步备课系列,共17页。













