

高中化学选择性必修二 第三章章末检测练习下学期(原卷版)
展开第三章章末检查
一、选择题
- 下列有关共价晶体的叙述,错误的是
A. 共价晶体中,原子不遵循紧密堆积原则
B. 共价晶体中不存在独立的分子
C. 共价晶体的熔点和硬度较高
D. 共价晶体熔化时不破坏化学键
- 下列关于金属晶体的叙述正确的是
A. 用铂金做首饰不能用电子气理论解释
B. 金属晶体的熔、沸点均很高
C. 金属晶体的最密堆积方式只有面心立方最密堆积
D. 金属导电和熔融电解质或电解质溶液导电的原理不一样
- 近年来,科学家合成了一些具有独特化学性质的氢铝化合物。已知,最简单的氢铝化合物的化学式为,它的熔点为,燃烧时放出大量的热量。的结构如图。下列说法肯定错误的是
A. 在固态时所形成的晶体是分子晶体
B. 氢铝化合物可能成为未来的储氢材料和火箭燃料
C. 在空气中完全燃烧,产物为氧化铝和水
D. 中含有离子键和极性共价键
- 配位化合物的数量巨大,组成和结构形形色色,丰富多彩。配合物的中心离子、配体和配位数分别为
A. 、、4 B. 、、4
C. 、、2 D. 、、2
- 下列数据是对应物质的熔点:
NaCl | 干冰 | ||||||
920 | 801 | 190 |
据此做出的下列判断中错误的是
A. 铝的化合物的晶体中有的是离子晶体
B. 表中只有干冰是分子晶体
C. 同族元素的氧化物可形成不同类型的晶体
D. 不同族元素的氧化物可形成相同类型的晶体
- 若X、Y两种粒子之间可形成配位键,则下列说法正确的是
A. X、Y只能是离子
B. 若X提供空轨道,则配位键表示为
C. X、Y分别为、时,作配体
D. 若X提供空轨道,则Y至少要提供一对孤电子对
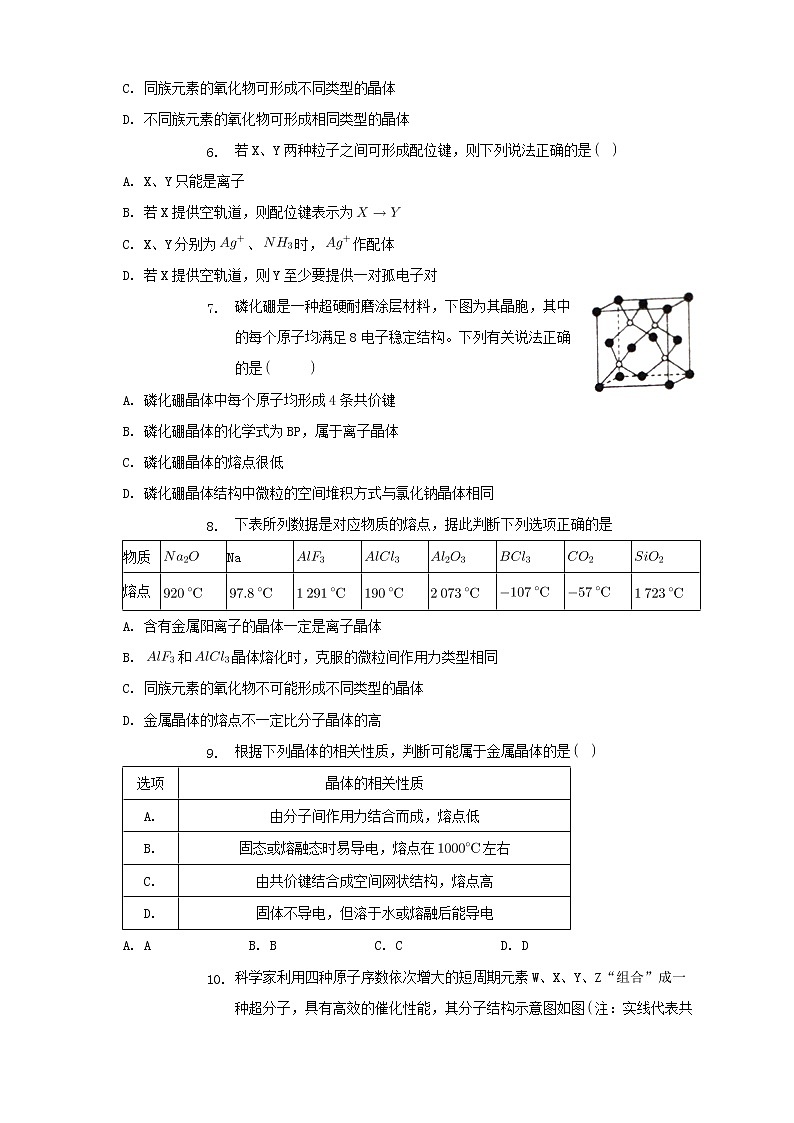
- 磷化硼是一种超硬耐磨涂层材料,下图为其晶胞,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是
A. 磷化硼晶体中每个原子均形成4条共价键
B. 磷化硼晶体的化学式为BP,属于离子晶体
C. 磷化硼晶体的熔点很低
D. 磷化硼晶体结构中微粒的空间堆积方式与氯化钠晶体相同
- 下表所列数据是对应物质的熔点,据此判断下列选项正确的是
物质 | Na | |||||||
熔点 |
A. 含有金属阳离子的晶体一定是离子晶体
B. 和晶体熔化时,克服的微粒间作用力类型相同
C. 同族元素的氧化物不可能形成不同类型的晶体
D. 金属晶体的熔点不一定比分子晶体的高
- 根据下列晶体的相关性质,判断可能属于金属晶体的是
选项 | 晶体的相关性质 |
A. | 由分子间作用力结合而成,熔点低 |
B. | 固态或熔融态时易导电,熔点在左右 |
C. | 由共价键结合成空间网状结构,熔点高 |
D. | 固体不导电,但溶于水或熔融后能导电 |
A. A B. B C. C D. D
- 科学家利用四种原子序数依次增大的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图注:实线代表共价键,其他重复单元的W、X未标注。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。下列说法中错误的是
A. Y单质的氧化性在同主族中元素单质最强
B. 简单离子半径:
C. Z与Y可组成不止一种离子化合物
D. 简单氢化物的热稳定性:
二、填空题
- 石墨晶体由层状石墨“分子”按方式堆积而成,如图甲所示,图中用虚线标出了石墨的一个六方晶胞。该晶胞中含有的碳原子数为_______。
石墨烯是一种由单层碳原子构成的平面结构新型碳材料,如图乙所示。设为阿伏加德罗常数的值,石墨烯中含有的六元环个数为_______。下列有关石墨烯的说法正确的是_______填字母。
晶体中碳原子间全部是单键
石墨烯中所有碳原子可以处于同一个平面
从石墨中剥离得到石墨烯需克服分子间作用力
石墨烯可转化为,的结构如图丙所示,该分子是由五边形和六边形构成的球体,其中五边形有12个,则六边形有_______个注:简单多面体的顶点数V、面数F及棱数E间的关系为。
金刚石晶胞如图丁所示,则金刚石晶胞中原子的配位数为_______。
- 金属钪是一种柔软、银白色的过渡金属,其中一种由酸式氟化铵和氧化钪及钙为原料的制备方法可用如下转化表示:
回答下列问题:
位于元素周期表的________区;基态Sc原子的价层电子轨道表示式为________。
酸式氟化铵的组成元素中,电负性由大到小的顺序为________;阳离子的空间构型为________,中心原子的杂化方式与________填“相同”或“不相同”;中,不存在________填标号。
A.离子键 键 键 氢键 配位键
是离子晶体,其晶格能符合下图的循环。
的晶格能为________;
________填“”或“”。
的晶胞如图所示,其中的配位数为________,的密度为,相邻的两个的最近核间距为,则的摩尔质量数值为________列出计算式,设为阿伏加德罗常数的值。
- Ⅰ两种硼氢化物的熔点如下表所示:
硼氢化物 | ||
熔点 | 400 |
两种物质熔点差异的原因是___。
在水中溶解度不大,而在水中溶解度较大,原因是:____。
的三聚体环状结构如所示,该结构中键长有a、b两类,b的键长大于a的键长的原因为____。
Ⅱ我国科学家最近成功合成了世界上首个五氮阴离子盐用R代表。回答下列问题:
元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能。第二周期部分元素的纵坐标变化趋势如图。
其中除氮元素外,其他元素的自左而右依次增大的原因是____;氮元素的呈现异常的原因是____。
用____实验方法测得化合物R的晶体结构,其局部结构如图所示:
从结构分析,R中两种阳离子的相同之处为____填标号,不同之处为____填标号。
A.中心原子的杂化类型
B.中心原子的价层电子对数
C.立体结构
R中阴离子具有含大键的平面结构,若大键可用符号表示,则中的大键应表示为____。
离子液体是一种只由离子组成的液体,在低温下也能以液态稳定存在,是一种很有研究价值的溶剂。最常见的离子液体主要由阴离子和以下的正离子组成。
图中正离子有令人惊奇的稳定性,它的电子在其环状结构中高度离域。该正离子中N原子的杂化方式为____。
为了使正离子以单个形式存在以获得良好的溶解性能,与N原子相连的不能被H原子替换,原因是____。
Ⅲ某种由阳离子X和阴离子Y形成的离子晶体晶胞结构如图所示深色为X离子,该晶体中Y离子的配位数为____,该化合物的化学式为___。
铜单质的堆积方式剖面图如图所示。
晶体中原子的空间利用率为___用含有的、化简的代数式表示。
- 铬锆铜合金具有优良性能,广泛应用于机械制造工业的焊接。已知锆位于第ⅣB族,根据要求回答下列问题:
铜元素在元素周期表的位置为________,基态Cr原子的价电子排布式为________。
形成铬锆铜合金的元素中,基态原子的第一电离能最大的是________填元素符号。下表是Fe与Cu的部分电离能数据,大于的主要原因是__________。
元素 | Fe | Cu |
第一电离能 | 759 | 746 |
第二电离能 | 1561 | 1958 |
配合物中的配体是_______,该配合物中N、O的杂化轨道类型分别为_________、__________。
硝酸铜是一种重要的工业原料,写出其阴离子的空间构型:________。
铜与氯形成晶体的晶胞如图所示,该晶体的化学式为___________;已知晶胞边长为,为阿伏加德罗常数的值,该晶体的密度为_______。
- 2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
基态铁原子的价电子排布式为______。
与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的______区。
实验室常用KSCN溶液、苯酚检验其中N、O、S的第一电离能由大到小的顺序为______用元素符号表示,苯酚中碳原子的杂化轨道类型为______。
铁元素能与CO形成羰基铁可用作催化剂、汽油抗爆剂等。分子中含______ 键,与CO互为等电子体的一种离子的化学式为______。
碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,分子占据顶点和面心处,占据的是分子围成的______空隙和______空隙填几何空间构型;若分子的坐标参数分别为0,,0,,1,等,则距离A位置最近的阳离子的原子坐标参数为______。
可以形成多种氧化物,其中一种晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为,且晶体中的Ni分别为、,则晶体中与的最简整数比为______,晶胞参数为,则晶体密度为______表示阿伏伽德罗常数的值,列出表达式。 - 铁、铬、锰统称为黑色金属,它们的单质、合金及其化合物在科研和生产中有着重要用途。
请回答下列问题:
基态铁原子的价电子轨道表示式为_______________________________。铁、铬、锰属于周期表中的____________________区元素。
基态铬原子和基态锰原子中第一电离能较大的是_____________________填元素符号,原因为____________________________________________________________。
化学式为的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量溶液,所得AgCl沉淀的物质的量之比为。
呈暗绿色的配合物内界的化学式为___________________________。
分子的VSEPR模型为___________________________。
写出两种与互为等电子体的分子的化学式:___________________。
和均为离子化合物,的熔点高于熔点的原因为___________________________________________。
一氧化锰在医药、冶炼上用途广泛,其立方晶胞结构如图所示。
该晶胞中由形成的正八面体空隙数目为__________________________。
设为阿伏加德罗常数的值,晶胞中距离最近的两个之间的距离为,则MnO晶体的密度_________用含a、的代数式表示。
- 304不锈钢是生活中常见的一种不锈钢,业内也叫做不锈钢,指必须含有以上的铬,以上的镍的不锈钢.
回答下列问题:
基态铬原子的价电子排布式为________________________,排布时能量最高的电子所占能级的原子轨道有________个伸展方向.
铬和镍能形成多种配合物.如为正四面体构型,为正方形构型,、为正八面体构型等.下列说法正确的是________填选项字母.
A.在形成配合物时其配位数只能为4,在形成配合物时其配位数只能为6
B.的空间构型为正四面体形
C.CO与互为等电子体,其中CO分子内键和键的个数比为
D.和中,镍原子均为杂化
年8月,云南一化工厂发生铬污染致数万立方米水质变差、牲畜接连死亡的消息引发社会各界的极大关注.与、互为等电子体,六价铬属于强致突变物质,可诱发肺癌和鼻咽癌,的空间构型为________________________.
的晶体结构类型与氯化钠相同,相关离子半径如下表所示:
NiO晶胞中的配位数为________________,NiO的熔点比NaCl高的原因是________________________________.
与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点都比金属Ca高,原因为________________________区分晶体Ni和非晶体Ni的最可靠的科学方法为________________________.
某铬镍合金的晶胞如图所示,设阿伏加德罗常数的值为,该晶体的密度________用含a、c、的代数式表示.
高中化学选择性必修二 第三章章末检测练习下学期(解析版): 这是一份高中化学选择性必修二 第三章章末检测练习下学期(解析版),共17页。
高中化学选择性必修二 第一章章末检测练习下学期(解析版): 这是一份高中化学选择性必修二 第一章章末检测练习下学期(解析版),共11页。
高中化学选择性必修二 第一章章末检测练习下学期(原卷版): 这是一份高中化学选择性必修二 第一章章末检测练习下学期(原卷版),共6页。













