资料中包含下列文件,点击文件名可预览资料内容






还剩16页未读,
继续阅读
所属成套资源:鲁教版化学九上课件PPT全套
成套系列资料,整套一键下载
鲁教版九年级上册第一节 化学反应中的质量守恒授课ppt课件
展开
这是一份鲁教版九年级上册第一节 化学反应中的质量守恒授课ppt课件,文件包含《化学反应中的质量守恒》精品课件pptx、化学反应前后质量是否变化mp4、红磷燃烧mp4、红磷燃烧注意事项mp4、质量守恒定律的原因mp4等5份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
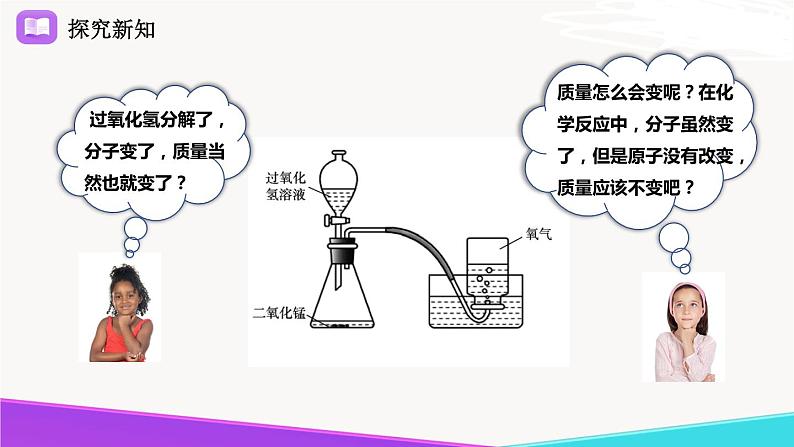
过氧化氢分解了,分子变了,质量当然也就变了?
质量怎么会变呢?在化学反应中,分子虽然变了,但是原子没有改变,质量应该不变吧?
分解了的过氧化氢的质量与生成的水和氧气的质量具有什么关系呢?
这个反应前后都有哪些分子和原子?
同学们的这两个观点都是从微观的角度去分析的,但理由好像并不是很充分。
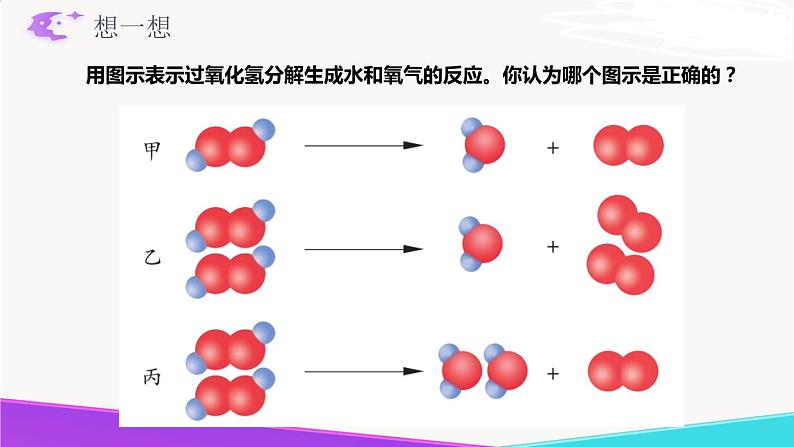
用图示表示过氧化氢分解生成水和氧气的反应。你认为哪个图示是正确的?
分解了的过氧化氢的质量与生成水和氧气的质量是相等的。
其他的化学反应前后的物质的总质量也可能是不变的。
【实验探究】探究化学反应前后物质的质量有无变化
(1)质量守恒定律适用于一切化学反应。运用这一定律时,特别要注意“参加化学反应”、“反应后生成”、“质量总和”等关键字词,不能遗漏任一反应物或生成物,尤其是气体。
(2)在验证质量守恒定律时,对于有气体参加或有气体生成的反应,都必须在密闭容器中进行。
10 g过氧化氢溶液完全分解后所得液体的质量小于10 g,所以在该实验中生成物质量减少。
镁条完全燃烧后生成物的质量大于反应前镁条的质量,所以在该实验中生成物质量增加。
不正确。因为参加反应的过氧化氢的质量,应该等于生成的水的质量和氧气的质量之和,题中漏掉了生成的氧气。
不正确。因为参加反应的镁条的质量和氧气的质量之和,应该等于生成的氧化镁的质量,题中漏掉了参加反应的氧气。
已知3 g碳可以与8 g氧气恰好完全反应,生成11 g二氧化碳。请你考虑:将3 g碳放在10 g氧气中充分燃烧后,能生成多少克二氧化碳?
生成11g二氧化碳。因为3 g碳可以与8 g氧气恰好完全反应,题中给出的10g氧气会剩余2g,而计算时只计算参加反应的物质之和,故仍为11g。
1673年,英国化学家煅烧金属汞实验。
1756年,俄国化学家罗蒙索诺夫煅烧金属锡实验。
1777年,法国化学家拉瓦锡进行多种金属和非金属的煅烧实验。
本节课我们通过实验探索了质量守恒定律,从化学反应的微观角度解释了质量守恒的原因,还知道了如何运用质量守恒定律解释实验现象。在知识探索的过程中,同学们能够积极思考、大胆探索、团结协作,共同取得进步,这是非常可取的。
1.下列有关质量守恒定律的认识,错误的是( )A.质量守恒定律揭示了化学变化中宏观物质之间的质量关系,与微观过程无关B.通过化学变化,只能改变世界上物质的种类,不能改变物质的总质量C.质量守恒定律为定量揭示化学变化的规律,提供了理论依据D.随着科技的发展,精密仪器为我们定量研究化学变化创造了条件
2.某纯净物M微热就能分解生成NH3、H2O和CO2,由此不能得出的结论是( )A.M不稳定 B.M中含有水 C.M是化合物 D.M由四种元素组成
3.把一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下,下列说法中正确的是( )A.a和c是反应物 B.d一定是催化剂C.x=2.0 D.该反应是化合反应
4.化学反应前后,下列诸项中肯定没有变化的是( )(1)原子的数目 (2)分子的数目 (3)元素的种类(4)物质的总质量 (5)物质的种类 (6)原子的种类A.(1)(3)(4)(5)(6) B.(1)(3)(4)(6)C.(1)(2)(4)(6) D.(1)(3)(5)
过氧化氢分解了,分子变了,质量当然也就变了?
质量怎么会变呢?在化学反应中,分子虽然变了,但是原子没有改变,质量应该不变吧?
分解了的过氧化氢的质量与生成的水和氧气的质量具有什么关系呢?
这个反应前后都有哪些分子和原子?
同学们的这两个观点都是从微观的角度去分析的,但理由好像并不是很充分。
用图示表示过氧化氢分解生成水和氧气的反应。你认为哪个图示是正确的?
分解了的过氧化氢的质量与生成水和氧气的质量是相等的。
其他的化学反应前后的物质的总质量也可能是不变的。
【实验探究】探究化学反应前后物质的质量有无变化
(1)质量守恒定律适用于一切化学反应。运用这一定律时,特别要注意“参加化学反应”、“反应后生成”、“质量总和”等关键字词,不能遗漏任一反应物或生成物,尤其是气体。
(2)在验证质量守恒定律时,对于有气体参加或有气体生成的反应,都必须在密闭容器中进行。
10 g过氧化氢溶液完全分解后所得液体的质量小于10 g,所以在该实验中生成物质量减少。
镁条完全燃烧后生成物的质量大于反应前镁条的质量,所以在该实验中生成物质量增加。
不正确。因为参加反应的过氧化氢的质量,应该等于生成的水的质量和氧气的质量之和,题中漏掉了生成的氧气。
不正确。因为参加反应的镁条的质量和氧气的质量之和,应该等于生成的氧化镁的质量,题中漏掉了参加反应的氧气。
已知3 g碳可以与8 g氧气恰好完全反应,生成11 g二氧化碳。请你考虑:将3 g碳放在10 g氧气中充分燃烧后,能生成多少克二氧化碳?
生成11g二氧化碳。因为3 g碳可以与8 g氧气恰好完全反应,题中给出的10g氧气会剩余2g,而计算时只计算参加反应的物质之和,故仍为11g。
1673年,英国化学家煅烧金属汞实验。
1756年,俄国化学家罗蒙索诺夫煅烧金属锡实验。
1777年,法国化学家拉瓦锡进行多种金属和非金属的煅烧实验。
本节课我们通过实验探索了质量守恒定律,从化学反应的微观角度解释了质量守恒的原因,还知道了如何运用质量守恒定律解释实验现象。在知识探索的过程中,同学们能够积极思考、大胆探索、团结协作,共同取得进步,这是非常可取的。
1.下列有关质量守恒定律的认识,错误的是( )A.质量守恒定律揭示了化学变化中宏观物质之间的质量关系,与微观过程无关B.通过化学变化,只能改变世界上物质的种类,不能改变物质的总质量C.质量守恒定律为定量揭示化学变化的规律,提供了理论依据D.随着科技的发展,精密仪器为我们定量研究化学变化创造了条件
2.某纯净物M微热就能分解生成NH3、H2O和CO2,由此不能得出的结论是( )A.M不稳定 B.M中含有水 C.M是化合物 D.M由四种元素组成
3.把一定质量的a、b、c、d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下,下列说法中正确的是( )A.a和c是反应物 B.d一定是催化剂C.x=2.0 D.该反应是化合反应
4.化学反应前后,下列诸项中肯定没有变化的是( )(1)原子的数目 (2)分子的数目 (3)元素的种类(4)物质的总质量 (5)物质的种类 (6)原子的种类A.(1)(3)(4)(5)(6) B.(1)(3)(4)(6)C.(1)(2)(4)(6) D.(1)(3)(5)













