






人教版 (2019)必修 第一册第二节 元素周期律教案配套课件ppt
展开1. 了解元素的原子结构和元素性质的周期性变化。2.能够以第三周期元素为例,说明同周期元素性质的递变情况。3.在理解元素周期律的内容和实质的基础上,形成结构决定性质的学科思想
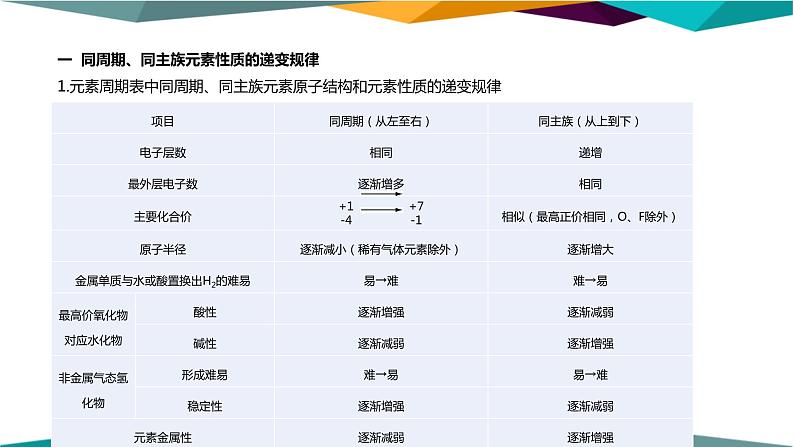
一 同周期、同主族元素性质的递变规律1.元素周期表中同周期、同主族元素原子结构和元素性质的递变规律
2.同周期、同主族元素原子结构及性质递变的原因(1)同周期元素,原子的电子层数相同,但核电荷数递增,原子核对外层电子的引力增大,原子半径减小,失电子能力减弱,而得电子能力增强。故同周期元素,自左向右金属性逐渐减弱,非金属性逐渐增强。(2)同主族元素,原子的最外层电子数相同,但电子层数增多,原子半径增大,原子核对外层电子的引力减小,得电子能力减弱,失电子能力增强。故同主族元素,自上而下金属性逐渐增强,非金属性逐渐减弱。
例1 下列各组性质比较中不正确的是( )A.酸性:H2SiO3
例2 同周期的X、Y、Z三种元素,它们最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )A.含氧酸的酸性H3ZO4>H2YO4>HXO4B.非金属性X>Y>ZC.元素的最低负化合价的绝对值X>Y>ZD.气态氢化物的稳定性按X、Y、Z的顺序增强
解析:同周期的X、Y、Z三种元素,它们最高价氧化物对应水化物是HXO4、H2YO4、H3ZO4,则这三种元素的最高正化合价分别是+7、+6、+5,原子序数越大,元素的最高正化合价越高。元素原子的最外层电子数与最高化合价相等。元素的原子序数越大,元素的非金属性就越强,最高价含氧酸的酸性就越强。A错,含氧酸的酸性H3ZO4
例3 短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是( )A.原子半径:W>X>Z>YB.热稳定性:H2Y>HZC.离子半径:W2+>Y2-D.碱性:XOH>W(OH)2
解析:核外电子排布相同,根据所带电荷数确定元素在周期表中的大概位置为 。A错,同周期元素的原子半径自左向右减小,同主族元素的原子半径自上而下增大,故原子半径的大小顺序为X>W>Y>Z。B错,热稳定性与非金属性有关,非金属性越强对应氢化物越稳定,同周期从左向右非金属性增强,稳定性HZ>H2Y。C错,电子层结构相同的离子,核电荷数越大半径越小,故离子半径W2+
例4 应用元素周期律分析下列推断,其中正确的组合是( )①卤素单质的熔点随原子序数的增大而升高②砹(At)是第ⅦA族元素,其氢化物的稳定性强于HCl③硫与硒(Se)同主族,硒(Se)的最高价氧化物对应水化物的酸性比硫酸弱④第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性⑤第三周期金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱①③④B. ①③⑤C. ③④⑤D. ②④⑤
解析:①对,卤素单质的熔点随原子序数的增大而升高。②错,同主族元素,原子序数越大,元素的非金属性越弱,气态氢化物的稳定性越差。非金属性At
例5 下列粒子半径比较中,正确的是( )Na+
解析:电子层数越多半径越大;电子层数相同的微粒,核电荷数越大半径越小;核电荷数相同时,电子数越多半径越大。A错,K+核外有3个电子层,Al3+、Mg2+、Na+均有2个电子层,且原子序数Na
例6 已知下列元素的原子半径:
解析:N、P是同一主族元素,P原子的电子层数比N原子的多,所以P的原子半径大于N的原子半径,Si、P、S是同一周期的元素,且原子序数Si
根据以上数据,磷元素的原子半径可能是( )0.80×10-10 mB. 1.10×10-10 m C. 1.20×10-10 mD. 0.70×10-10 m
解析:根据元素周期表短周期部分的结构和题意,W是第二周期元素,X、Y、Z都是第三周期元素。W与X的最高化合价之和为8,氟和氧都没有与族数相对应的最高化合价,则W是氮,X是铝,进而可知Y是硅,Z是磷。A对,原子半径X>Z,Z>W,则W
例8 [2018·天津卷]下列有关物质性质的比较,结论正确的是( )A.溶解度:Na2CO3
例3 [2017·天津卷第5题改编]根据元素周期表和元素周期律,判断下列叙述不正确的是( )A.气态氢化物的稳定性:H2O>NH3>SiH4B.氢元素与其他元素形成化合物时既可显正价也可显负价C.下图所示实验可证明元素的非金属性:Cl>C>SiD.用中文“ ”(à)命名的第118号元素在周期表中位于第七周期0族
解析:根据元素周期律可知,同周期自左向右、同主族自下而上,元素的非金属性逐渐增强、金属性逐渐减弱,最高价氧化物对应水化物的酸性增强,碱性减弱,则A、B、C三项均可根据元素周期律解释。无法根据元素周期律的知识来解释D项中盐的热稳定性大小。答案:D
例9 下列有关性质的比较,不能用元素周期律解释的是( )A.酸性:H2SO4>H3PO4 B.非金属性:Cl>Br C.碱性:NaOH>Mg(OH)2 D.热稳定性:Na2CO3>NaHCO3
高中化学人教版 (2019)必修 第一册第二节 元素周期律完美版课件ppt: 这是一份高中化学人教版 (2019)必修 第一册<a href="/hx/tb_c161998_t3/?tag_id=26" target="_blank">第二节 元素周期律完美版课件ppt</a>,共40页。PPT课件主要包含了归纳小结,同周期,同主族,同元素,同结构,从1-2或1-8,从大到小,从小到大,金减弱非金增强,金增强非金减弱等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律多媒体教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律多媒体教学课件ppt,共32页。PPT课件主要包含了夯基提能·一遍过,答案B,答案C,逐渐增多,不溶解,核外电子排布,HClO4,SiH4,NaOH,Al2O3等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律课堂教学课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律课堂教学课件ppt,共37页。













