




所属成套资源:人教版高中化学必修第一册全册课件PPT+同步练习(含答案)
人教版 (2019)必修 第一册第一节 原子结构与元素周期表说课ppt课件
展开
这是一份人教版 (2019)必修 第一册第一节 原子结构与元素周期表说课ppt课件,共13页。PPT课件主要包含了学习目标,体验高考等内容,欢迎下载使用。
1.知道质量数、元素、核素、同位素的含义,学会原子的表示方法。2.了解原子核外电子的排布。
一 原子结构1.构成原子的粒子间的关系(1)质量数(A)=质子数(Z)+中子数(N)(2)数量关系:核电荷数=质子数=核外电子数(3)电性关系
2.核外电子排布的规律(1)能量最低原理原子核外电子总是先排布在能量最低的电子层,然后由里向外,依次排布在能量逐步升高的电子层(能量最低原理),即排满了K层才排L层,排满了L层才排M层。(2)原子核外各电子层最多容纳2n2个电子。(3)原子最外层电子数不超过8(K层为最外层时不超过2)。(4)次外层最多能容纳的电子数不超过18,倒数第三层最多能容纳的电子数不超过32。
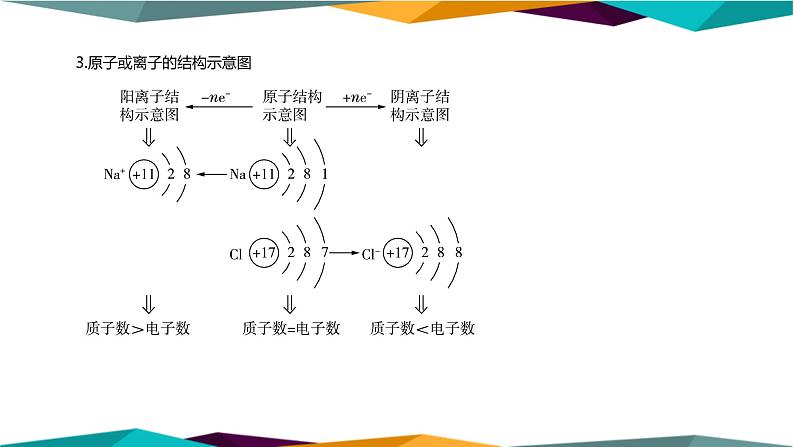
3.原子或离子的结构示意图
例1 某金属原子的符号为 ,该原子核内的中子数与核外电子数之差为( )32B. 67C. 99D. 166
解析:由题意知, 核外电子数等于核电荷数,为67,原子核内的中子数为166-67 = 99,其与核外电子数之差为99-67=32。答案:A
例2 核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素有 ( )1种B. 2种C. 3种D. 4种
解析:若该原子有两个电子层,内层只有一个电子层,电子数为2,最外层电子数为1,为锂元素;若该原子有三个电子层,内层有两个电子层,电子数为10,最外层电子数为5,为磷元素。答案:B
例3 下列说法中正确的是 ( ) A.某微粒结构示意图为 ,则该微粒一定是氩原子B.最外层达到稳定结构的微粒只能是稀有气体的原子C. F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子层结构的离子D.某元素原子的最外层只有2个电子,则该元素一定是金属元素
解析:A错,该微粒不一定是Ar原子,可能是Cl-、K+等。B错,最外层达到稳定结构的微粒不一定是稀有气体的原子,也可能是达到稳定结构的阴离子或阳离子。C对,F-、Na+、Mg2+、Al3+都有2个电子层,第1层上2个电子,第2层上8个电子,与Ne原子有相同的电子层结构。D错,原子的最外层只有2个电子,该元素不一定是金属元素,也可能是He元素。答案:C
例4 [2019•河南周口一中高一月考]下列叙述中不正确的是( )A.原子的核外M层电子数是L层电子数一半的元素是硅B.原子的最外层电子数是次外层电子数1.5倍的元素是硼C.原子的次外层电子数是最外层电子数1/3的元素是氧D.原子最外层电子数与次外层电子数相等的元素是铍
解析:A对,原子M层上有电子时,L层应排满8个电子,M层有4个电子,该元素为硅元素。B对,原子最外层电子数大于次外层电子数,次外层只能为K层,有2个电子,最外层为L层,有3个电子,该元素为硼元素。C对,原子最外层电子数大于次外层电子数,次外层只能为K层,有2个电子,最外层为L层,有6个电子,该元素为氧元素。D错,原子最外层电子数与次外层电子数相等的元素可能是铍或氩。答案:D
例5 短周期元素X,其原子核外电子层数为a,最外层电子数为(2a+1),原子核内质子数为(2a2-1)。下列有关元素X的说法中,不正确的是( )A.元素X可能形成化学式为KXO3的含氧酸钾盐B.元素X不可能在第一周期C.元素X形成的简单离子,各电子层的电子数均达到2n2(n表示电子层数)D.由元素X形成的某些化合物,可能具有杀菌、消毒的作用
解析:短周期元素X,其原子的电子层数为a,最外层电子数为(2a+1),原子核内质子数为(2a2-1),若a=1,最外层电子数为3,不符合题意;若a=2,最外层电子数为5,质子数为7,符合题意;若a=3,最外层电子数为7,质子数为17,符合题意。A对,X元素为N或Cl,可形成化学式为KNO3或KClO3的含氧酸钾盐。B对,N元素处于第二周期,Cl元素处于第三周期。C错,Cl-的核外电子排布为 ,最外层电子数达不到2n2。D对,如果X为Cl,则可形成HClO,具有杀菌、消毒作用。答案:C
解析:A错,18O3中子数为(18-8)×3=30。B错,2H217O2中子数为(2-1)×2+(17-8)×2=20。C错,14N16O2中子数为14-7+(16-8)×2=23。D对,14C16O2中子数为14-6+(16-8)×2=24。答案:D
例1 [海南卷]下列分子中,其中子总数为24的是( )18O3 B. 2H217O2C. 14N16O2 D. 14C16O2
解析:A对,元素周期表中第七周期0族应为118号元素。117号元素位于118号左侧,即Ts是第七周期第ⅦA族元素。B对,同位素是同种元素不同原子之间的互称,同种元素的原子核外电子数相等。C对,元素周期表中同族元素自上而下非金属性依次减弱,故Ts在同族元素中非金属性最弱。D错,中子数为176的Ts核素,其质量数为176+117=293,所以这种核素符号是293117Ts。答案:D
例2 [北京卷]2016年IUPAC命名117号元素为Ts(中文名“ ”,tián),Ts的原子核外最外层电子数是7。下列说法不正确的是( ) A. Ts是第七周期第ⅦA族元素B. Ts的同位素原子具有相同的电子数 C. Ts在同族元素中非金属性最弱D.中子数为176的Ts核素符号是176117Ts
解析:A错,重水为21H2168O,其中21H含有1个中子,168O含有8个中子,所以1个重水分子含有10个中子,1 ml重水含有10 ml中子。水为11H2168O,其中11H没有中子,168O含有8个中子,所以1个水分子含有8个中子,1 ml水含有8 ml中子。两者的中子数之比为10∶8=5∶4。B对,3 g 3He所含的中子数:3 g÷3 g·ml-1×NA ml-1=1NA。C错,23592U+10n 9038Sr+13654Xe+1010n净产生的中子(10n)数为9,则235 g即1 ml 23592U发生裂变反应净产生的中子数为9NA。D错,1个D2O和H2O分子中质子数均为10,D和H的质量数不同,则18 g D2O和18 g H2O的物质的量不同,所以含有的质子数不同。答案:B
例3 [高考题组合]下列说法正确的是( )A. 1 ml重水与1 ml水中,中子数比为2∶1 [2018·全国Ⅲ卷]B. 3 g 3He含有的中子数为1NA [2019·全国Ⅱ卷]C. 235 g核素23592U发生裂变反应:23592U+10n 9038Sr+13654Xe+1010n,净产生的中子(10n)数为10NA[2015·全国Ⅱ卷] D. 18 g D2O和18 g H2O中含有的质子数均为10NA[2015·全国Ⅰ卷]
相关课件
这是一份化学人教版 (2019)第一节 原子结构与元素周期表课文课件ppt,文件包含新教材精创412原子结构与元素的性质课件2pptx、氯溴碘的置换wmv、钾钠与水的反应对比实验wmv等3份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
这是一份高中化学鲁科版 (2019)必修 第二册第1节 原子结构与元素性质教案配套ppt课件,共60页。PPT课件主要包含了联想·质疑,原子核核素,原子核的构成,迁移·应用,观察·思考,化学与技术,核外电子排布,交流·研讨,资料在线,概括整合等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第一册第一节 原子结构与元素周期表评课课件ppt,文件包含第四章第一节原子结构与元素周期律课时4pptx、3原子结构与元素周期表pptx、2原子结构与元素周期表pptx、1原子结构与元素周期表pptx等4份课件配套教学资源,其中PPT共78页, 欢迎下载使用。










