





高中化学选修三--全套课件
展开第一章 原子的结构与性质
第一节 原子结构(第一课时)高二化学组
知识与技能目标: 1.进一步认识原子核外电子的分层排布 2.知道原子核外电子的能层分布及其能量关系 3.知道原子核外电子的能级分布及其能量关系 4.能用符号表示原子核外的不同能级,初步知道量子数的涵义 5.了解原子结构的构造原理,能用构造原理认识原子的核外电子排布 6.能用电子排布式表示常见元素(1~36号)原子核外电子的排布
一、开天辟地——原子的诞生
宇宙大爆炸2小时:大量氢原子、少量氦原子 极少量锂原子
140亿年后的今天: 氢原子占88.6% 氦原子为氢原子数1/8 其他原子总数不到1%
包括稀有气体在内的非金属仅22种
地壳中含量在前五位:O、Si、Al、Fe、Ca
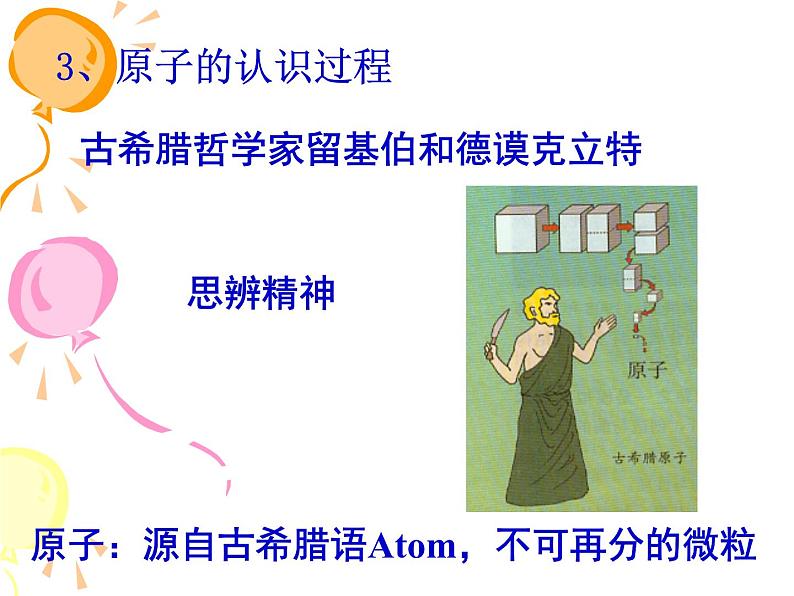
古希腊哲学家留基伯和德谟克立特
原子:源自古希腊语Atm,不可再分的微粒
1803年 道尔顿(英)
原子是微小的不可分割的实心球体
1897年,英国科学家汤姆生
1911年,英国物理学家卢瑟福
电子绕核旋转的原子结构模型
1913年,丹麦科学家玻尔行星轨道的原子结构模型
1926年,奥地利物理学家薛定谔等以量子力学为基础提出电子云模型
与物质化学性质密切相关
一 二 三 四 五 六 七
K L M N O P Q
从K至Q ,能层离核越远,能层能量越大
每层最多容纳电子的数量:2n2
同一个能层中电子的能量相同的电子亚层
能级名称:s、p、d、f、g、h……
能级符号:ns、np、nd、nf……
能层: 一 二 三 四……
K L M N ……
3s 3p 3d
4s 4p 4d 4f
最多容纳电子的数量 s:2 p:6 d:10 f:14
每一能层的能级从s开始,s,p,d,f……
能层中能级的数量不超过能层的序数
EK﹤EL ﹤ EM ﹤ EN
Ens﹤Enp ﹤ End ﹤ Enf
Ens﹤E(n+1) s ﹤ E(n+2) s ﹤ E(n+3) s
Enp﹤E(n+1)p ﹤ E(n+2)p ﹤ E(n+3)p
三、构造原理与电子排布式
多电子基态原子的电子按能级交错的形式排布
1s→ 2s → 2p → 3s → 3p→ 4s → 3d → 4p → → 5s → 4d → 5p →→ 6s → 4f → 5d → 6p……
例:写出Zn的电子排布式
Zn为30号元素,电子共30个
1s2 2s2 2p6 3s2 3p6 4s2 3d10
书写时:1s2 2s2 2p6 3s2 3p6 3d10 4s2
写出K Ca Ti C Ga Kr Br的电子排布式
Zn:1s2 2s2 2p6 3s2 3p6 3d10 4s2
Zn:[Ar] 3d10 4s2
写出K Ca Ti C Ga Kr Br的简化电子排布式
价层电子:主族、0族元素最外层 副族、Ⅷ族最外层和次外层
例:写出Cr和Cu的电子排布式
第一章第一节原子结构 (第二课时)
知识与技能目标:1、了解原子结构的构造原理,能用构造原理认识原子的核外电子排布2、能用电子排布式表示常见元素(1~36号)原子核外电子的排布3、知道原子核外电子的排布遵循能量最低原理、泡利原理和洪特规则 4、知道原子的基态和激发态的涵义5、初步知道原子核外电子的跃迁及吸收或发射光谱,了解其简单应用
四、电子云与原子轨道
处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述
单位体积内出现的概率
小黑点越密概率密度越大
电子出现的概率约为90%的空间
③电子云轮廓图特点
nd能级的电子云轮廓图:多纺锤形
ns能级的电子云轮廓图:球形
np能级的电子云轮廓图:双纺锤形
同类电子云能层序数n越大,电子能量越 大,活动范围越大电子云越向外扩张
电子在原子核外的一个空间运动状态
同一能级中的轨道能量相等,称为简并轨道
③原子轨道的电子云轮廓图
npx轨道电子云轮廓图
npy轨道电子云轮廓图
npz轨道电子云轮廓图
nd轨道电子云轮廓图
五、泡利原理和洪特规则
每个轨道最多只能容纳2个电子
且它们的自旋方向相反
电子总是优先单独地占据简并轨道
且它们的自旋方向相同
例:写出O原子的电子排布图
O原子的电子排布式:
1s2 2s2 2p4
1s2 2s2 2p4
O原子:1s2 2s2 2p4
六、能量最低原理、基态与激发态、光谱
能量最低原理:原子电子排布遵循构造原理 能使整个原子的能量处于最低
基态原子:遵循泡利原理、洪特规则、能量 最低原理的原子
基态原子吸收能量后,电子发生跃迁变为激发态原子
电子吸收能量跃迁时产生
电子释放能量跃迁时产生
同种原子的两种光谱是可以互补的
第二节 原子结构与元素性质(共三课时)高二化学组
1、掌握原子半径的变化规律2、能说出元素电离能的涵义,能应用元素的电离能说明元素的某些性质3、进一步形成有关物质结构的基本观念,初步认识物质的结构与性质之间的关系4、认识主族元素电离能的变化与核外电子排布的关系5、认识原子结构与元素周期系的关系,了解元素周期系的应用价值 6、能说出元素电负性的涵义,能应用元素的电负性说明元素的某些性质
复习元素:具有相同核电荷数的一类原子的总称
核素:含有一定数目质子和中子的一种原子
同位素:质子数相同中子数不同的 同一种元素的不同原子
核电荷数=核内质子数=核外电子数=原子序数
质量数A= 质子数Z+ 中子数N
一、原子结构与元素周期表 (一课时)
同周期元素电子层数相同
同周期元素从左至右原子依次序数递增
镧系:57~71 锕系:89~103
第七周期也称为不完全周期
, ⅢB~ⅦB,ⅠB,ⅡB
主族元素族序数=原子最外层电子数
副族、Ⅷ族通称过渡元素,过渡金属
按最后填入电子所属能级符号ds区除外
3 ~ 7、8 ~ 10 八列
13 ~ 17、18 六列
二、元素周期律(第二课时)
元素周期律:元素的性质随着原子序数的递增而呈周期性的变化
同周期主族元素:从左至右原子半径递减
同主族元素:从上至下原子半径递增
电子层结构相同的离子原子序数小的半径大!
气态电中性基态原子失去一个电子转化为气态基态正离子所需最低能量
同周期主族元素第一电离能从左至右逐渐升高
ⅡA、ⅤA反常!比下一主族的高
利用逐级电离能判断化合价
3、电负性(第三课时)
键合电子:参与化学键形成
孤对电子:未参与化学键形成
不同元素的原子对键合电子吸引能力
电负性越大,对键合电子吸引能力越大
同周期主族元素从左至右电负性逐渐变大
同主族元素从上至下电负性逐渐变小
一般而言金属<1.8,非金属>1.81.8左右的既有金属性,又有非金属性
对角线规则:元素周期表中的某些主族元素 其某些性质与右下角元素相似
4、金属性与非金属性
金属性:金属单质的还原性 非金属性:非金属单质的氧化性
同周期的主族元素从左至右
金属性减弱,非金属性增强
金属性增强,非金属性减弱
最高价氧化物对应水化物——最高价氢氧化物 碱性强弱 最高价氢氧化物碱性越强,金属性越强
金属性强弱的判断依据
跟水(酸)反应置换出氢的难易程度 越容易发生,金属性越强
单质与盐溶液的置换反应
气态氢化物的稳定性 越稳定,非金属性越强
非金属性强弱的判断依据
最高价氧化物对应水化物——最高价含氧酸酸性强弱 酸性越强,非金属性越强
跟氢气化合生成气态氢化物的难易程度 越易反应,非金属性越强
化合价由+1→+7, -4 →0递增巩固练习见资料
主族元素族序数=最高正价=价电子数
非金属最低负化合价=主族元素族序数—8
第二章 分子的结构与性质
第一节 共价键高二化学组
教学目标:1、复习化学键的概念,能用电子式表示常见物质的离子键或共价键的形成过程。2、知道共价键的主要类型δ键和π键。3、说出δ键和π键的明显差别和一般规律。
相邻原子或离子之间强烈的相互作用
共用电子对(两单个电子形成一对电子)
共价键:分子内原子间通过共用电子对形成的相互作用
于绝大多数物质中酸、碱、盐、非金属氧化物氢化物、有机物、非金属单质
两个原子轨道沿键轴方向以“头碰头”的方式重叠
两个原子轨道以平行即“肩并肩”方式重叠
重叠程度较小,稳定性较差
平行方向“肩并肩”
单键是σ键,双键中一个 σ键,另一个是π键,共价三键中一个是σ键,另两个为π键。
共价键类型(按电子云重叠方式分)
教学目标:1、了解键的参数,能用键能、键长、键角说明简单分子的性质。2.了解等电子体原理的涵义,并能说明物质的一些性质。
二、键参数——键能、键长与键角
气态基态原子形成1ml 化学键释放的最低能量
释放能量,取正值
键能越大,键越牢固,分子越稳定
观察表2-1 某些共价键的键能
同种元素形成的共价键的键能: 单键<双键<叁键σ键键能> π键键能
形成共价键的两个原子间的核间距
同种原子的共价键键长的一半
稀有气体为单原子分子,无共价半径
键长越短,键能越大,分子越稳定
观察表2-2 某些共价键的键能
同种元素间形成的共价键的键长: 单键>双键>叁键
两个共价键之间的夹角
CH4 CCl4 109°28′
NH3107°18′
H2O 105°
CO2 180°
衡量共价键的稳定性
注意:有时将原子总数、价电子总数相同的 离子也认为是等电子体
原子总数相同、价电子总数相同的分子
具有相似的化学键特征许多性质是相近的
3、常见等电子微粒:
10e—、18e—练习见资料
第二节 分子的立体结构高二化学组
第二节分子的立体构型 (第一课时)
教学目标:认识共价分子的多样性和复杂性;初步认识价层电子对互斥模型;能用VSEPR模型预测简单分子或离子的立体结构;培养学生严谨认真的科学态度和空间想象能力。重点难点:分子的立体结构;利用价层电子对互斥模型预测分子的立体结构
1、三原子分子的空间结构
2、四原子分子的空间结构
3、五原子分子的空间结构
二、价层电子对互斥(VSEPR)理论
( Valence Shell Electrn Pair Repulsin )
共价分子中,中心原子周围电子对排布的几何构型主要取决于中心原子的价层电子对的数目。价层电子对各自占据的位置倾向于彼此分离得尽可能的远,此时电子对之间的斥力最小,整个分子最稳定。
价层电子对包括成键的σ电子对和孤电子对
不包括成键的π电子对 !
2、价层电子对数计算
①确定中心原子价层电子对数目
价电子数出现奇数时,单电子当作电子对看待
=(中心原子价电子数+结合原子数)/2
=配位原子数+孤电子对数
=σ键电子对数+孤电子对数
O、S为结合原子时,按“0 ”计算
N为结合原子时,按“- 1 ”计算
离子计算价电子对数目时,阴离子加上所带电荷数,阳离子减去所带电荷数
孤电子对数=价层电子对数 — 结合原子数
②确定价层电子对构型
注意:孤对电子的存在会改变键合电子对 的分布方向,从而改变化合物的键角
电子间斥力大小: 孤对间>孤对与键合间>键合间
在价层电子对构型的基础上,去掉孤电子对由真实原子形成的构型
1.下列物质中分子立体结构与水分子相似的是 A.CO2 B.H2S C.PCl3 D.SiCl42.下列分子立体结构其中属于直线型分子的是 A.H2O B.CO2 C.C2H2 D.P43.下列分子立体结构其中属正八面体型分子的 A.H3O + B.CO32— C.PCl5 D.SF6
会利用VSEPR理论得出孤电子对数价层电子对构型分子构型
教学目标:1、认识杂化轨道理论的要点2、进一步了解有机化合物中碳的成键特征3、能根据杂化轨道理论判断简单分子或离子的构型 4.采用图表、比较、讨论、归纳、综合的方法进行教学 5.培养学生分析、归纳、综合的能力和空间想象能力教学重点: 杂化轨道理论的要点
① 同一原子中能量相近的不同种原子轨道 在成键过程中重新组合,形成一系列能量相等的新轨道的过程叫杂化。形成的新轨道叫杂化轨道,用于形成σ键或容纳孤对电子
② 杂化轨道数目等于各参与杂化的原子轨道 数目之和
③ 杂化轨道成键能力强,有利于成键
④ 杂化轨道成键时,满足化学键间最小排斥原理,不同的杂化方式,键角大小不同
⑤ 杂化轨道又分为等性和不等性杂化两种
1个s轨道和3个p轨道杂化形成4个sp3杂化轨道
构型 109°28′ 正四面体型
4个sp3杂化轨可形成4个σ键
价层电子对数为4的中心原子采用sp3杂化方式
1个s轨道和2个p轨道杂化形成3个sp2杂化轨道
构型 120° 正三角型
剩下的一个未参与杂化的p轨道用于形成π键
3个sp2杂化轨道可形成3个σ键
价层电子对数为3的中心原子采用sp2杂化方式
1个s轨道和1个p轨道杂化形成2个sp杂化轨道
构型 180° 直线型
剩下的两个未参与杂化的p轨道用于形成π键
2个sp杂化轨道可形成2个σ键
价层电子对数为2的中心原子采用sp杂化方式
除C原子外,N、O原子均有以上杂化
当发生sp2杂化时,孤对电子优先参与杂化单电子所在轨道优先不杂化,以利于形成π键
N、O原子杂化时,因为有孤对电子的存在称为不等性杂化
dsp2杂化、sp3d杂化、sp3d2杂化、d2sp3杂化、 sp3d2杂化
例如:sp3d2杂化:SF6
构型:四棱双锥 正八面体
此类杂化一般是金属作为中心原子用于形成配位化合物
教学目标1.配位键、配位化合物的概念2.配位键、配位化合物的表示方法3.采用图表、比较、讨论、归纳、综合的方法进行教学4.培养学生分析、归纳、综合的能力教学重点 配位键、配位化合物的概念教学难点配位键、配位化合物的概念
①定义:共用电子对由一个原子单方向 提供给另一个原子共用所形成| 的共价键称配位键。
一个原子有孤对电子,另一个原子有空轨道。
[Cu(NH3) 4 ] SO4•H2O
加乙醇 并静置
继续滴 加氨水
Cu(OH)2 + 4NH3 = [Cu(NH3)4]2+ + 2OH—
Cu2++ 2NH3·H2O = Cu(OH)2↓+ 2NH4+
1Cu与4O形成的结构为平面正方形
1Cu与4N形成的结构为平面正方形
[Ag(NH3)2] OH
[Ag(NH3)2]+
(有时可能 是中心原子)
配位数:配位原子的个数
常见配位原子:N、O、F、Cl、C、S
Fe3+ + 3SCN— = Fe(SCN)3
Fe3+ + nSCN— = [Fe(SCN)n ]3-n (n=1-6)
AgOH+2NH3·H2O = [Ag(NH3)2]++ OH—+2H2O
Ag++ NH3·H2O = AgOH↓+ NH4+
二氨合银离子 无色
冰晶石(六氟合铝酸钠):Na3[AlF6]
教学目标了解极性共价键和非极性共价键;结合常见物质分子立体结构,判断极性分子和非极性分子;培养学生分析问题、解决问题的能力和严谨认真的科学态度。重点、难点多原子分子中,极性分子和非极性分子的判断。
一、键的极性和分子的极性
①非极性共价键(非极性键)
由同种原子形成化学键
原子带相同电性,化合价相同
② 极性共价键(极性键)
由不同种原子形成化学键
电负性大(非金属性强)的原子带负电,显负价
正负电荷中心重合的分子
其他正多面体形、对称性好的平面形
例:BF3、SO3
例:CH4 、 CCl4
例:C60 、C6H6、C2H4 、C2H2
正负电荷中心不重合的分子
键的极性与分子极性的关系:
A、由非极性键构成的分子一般是非极性分子 B、极性键结合形成的分子不一定为极性分子
教学目标范德华力、氢键及其对物质性质的影响能举例说明化学键和分子间作用力的区别例举含有氢键的物质采用图表、比较、讨论、归纳、综合的方法进行教学培养学生分析、归纳、综合的能力教学重点 分子间作用力、氢键及其对物质性质的影响教学难点 分子间作用力、氢键及其对物质性质的影响
二、范德华力及其对物质性质的影响
把分子聚集在一起的作用力叫做分子间作用力又叫范德华力
相对分子质量越大 范德华力越大
2、影响范德华力的因素
分子极性越大 范德华力越大
3、范德华力对物质性质的影响
化学键影响的是分子的稳定性(化学性质)
范德华力影响的是分子熔沸点等(物理性质)
由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力
除范德华力以外的另一种分子间作用力,不是化学键
“…”表示形成的氢键
3、氢键的分类
4、氢键的特征
一个氢原子只能形成一个氢键
分子间氢键为直线型
分子内氢键成一定角度
中心原子有几对孤对电子就可以形成几条氢键
5、对物质性质的影响
氢键一种分子间作用力,影响的是物理性质
分子间氢键使物质熔点升高分子内氢键使物质熔点降低
若可以形成氢键,则能增大物质溶解度
非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
教学目标1、从分子结构的角度,认识“相似相溶”规律。2、了解“手性分子”在生命科学等方面的应用。3、能用分子结构的知识解释无机含氧酸分子的酸性。4、培养学生分析、归纳、综合的能力5、采用比较、讨论、归纳、总结的方法进行教学教学重点、难点 手性分子和无机含氧酸分子的酸性
连有四个不同的原子或原子团的碳原子。
手性异构体:具有完全相同的组成和原子排列的一对分子。又称为对映异构体。
手性分子: 有手性异构体的分子。
1.下列化合物中含有手性碳原子的是( )A.CCl2F2 B.CH3—CH—COOHC.CH3CH2OH D.CH—OH
六、无机含氧酸分子的酸性
无机含氧酸可以写成(HO)mROn,含氧酸的强度随着分子中连接在中心原子上的非羟基氧的个数增大而增大,即(HO)mROn中,n值越大,酸性越强。
2、最高价含氧酸酸性
非金属性强的元素,其最高价含氧酸酸性强
第三章 晶体的结构与性质
教学目标:了解晶体的初步知识,知道晶体与非晶体的本质差异,学会识别晶体与非晶体的结构示意图。知道晶胞的概念,了解晶胞与晶体的关系,学会通过分析晶胞得出晶体的组成。培养空间想像能力和进一步认识“物质结构决定物质性质”的客观规律
晶体——具有规则几何外形的固体
非晶体——没有规则几何外形的固体 又称玻璃体
2、晶体与非晶体性质对比
原子在三维空间里呈周期性有序排列
强度、导热性、光学性质等
无固定 熔沸点
晶体能自发地呈现多面体外形的性质
自范性前提:晶体生长的速率适当
不同方向上,性质有差异
3、晶体形成的途径
②气态物质冷却不经液态直接凝固(凝华)
①物理性质差异 如:外形、硬度、熔点、折光率
②最科学的方法是对固体进行X-射线衍射实验
1、下列关于晶体与非晶体的说法正确的是 A、晶体一定比非晶体的熔点高 B、晶体有自范性但排列无序 C、非晶体无自范性而且排列无序 D、固体SiO2一定是晶体2、区别晶体与非晶体最可靠的科学方法是 A、熔沸点 B、硬度 C、颜色 D、x-射线衍射实验
1、晶胞:描述晶体结构的基本单元
晶胞是无形的,是人为划定的
晶体由晶胞“无隙并置”而成
3、三种典型立方晶体结构
4.晶胞中原子个数的计算
晶胞顶角原子为8个晶胞共用,每个晶胞占1/8
晶胞棱上原子为4个晶胞共用,每个晶胞占1/4
晶胞面上原子为2个晶胞共用,每个晶胞占1/2
晶胞内部的原子为1个晶胞独自占有,即为1
1、现有甲、乙、丙、丁四种晶胞,可推知:甲晶体中A与B的离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为______;丁晶体可能的化学式为______。
2、下图依次是金属钠(Na)、金属锌(Zn)、碘(12)、金刚石(C)晶胞的示意图,数一数,它们分别平均含有几个原子?
3、钙-钛矿晶胞结构如图所示。观察钙-钛矿晶胞结构,求该晶体中,钙、钛、氧的微粒个数比为多少?
4、下图是CO2分子晶体的晶胞结构示意图,其中有多少个原子?
5、最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是 。
第二节 分子晶体与原子晶体
教学目标:了解分子晶体的晶体结构模型及其性质的一般特点。理解分子晶体的晶体类型与性质的关系了解分子间作用力对物质物理性质的影响了解氢键及其物质物理性质的影响。
一、分子晶体1.结构特点(1)构成微粒及微粒间的作用力
(2)微粒堆积方式①若分子间只有范德华力,则分子晶体有______特征,即每个分子周围有___个紧邻分子。②若分子间含有其他作用力,如氢键。由于氢键具有_____,使分子不能采取密堆积的方式,则每个分子周围紧邻的分子要少于12个。如冰中每个水分子周围只有4个紧邻的水分子。
2.属于分子晶体的物质(1)所有_________,如H2O、NH3、CH4等。(2)部分非金属单质,如卤素(X2)、O2、N2、白磷(P4)、硫(S8)、稀有气体等。(3)部分____________,如CO2、P4O6、P4O10、SO2等。(4)几乎所有的____,如HNO3、H2SO4、H3PO4、H2SiO3等。(5)绝大多数有机物的晶体,如苯、乙醇。
分子内原子间以共价键结合相邻分子间靠分子间作用力(范德华力、氢键)相互吸引
⑤绝大多数有机物的晶体
①若分子间只有范德华力时
以1个分子为中心,周围有12个紧邻分子,即分子密堆积结构
②若分子间主要为氢键时
以1个分子为中心,周围有4个相邻分子,即分子非密堆积结构。如:HF 、NH3、冰等
固态和熔融状态时都不导电只有酸的水溶液有的导电
1.下列性质适合于分子晶体的是( ) A.熔点1070℃,易溶于水,水溶液导电 B.熔点10.31 ℃,液态不导电、水溶液能导电 C.易溶于CS2、熔点112.8 ℃,沸点444.6℃ D.熔点97.81℃,质软、导电、密度0.97g/cm3
2.共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是 ( )A.干冰 B.氯化钠 C.氢氧化钠 D.碘
3.下列分子晶体:①H2O ②HCl ③ HBr ④HI ⑤CO ⑥N2 ⑦H2熔沸点由高到低的顺序是( ) A.①②③④⑤⑥⑦ B.④③②①⑤⑥⑦ C.①④③②⑤⑥⑦ D.⑦⑥⑤④③②①
5.下列过程中,共价键被破坏的是( ) A.碘升华 B.溴蒸气被木炭吸附 C.酒精溶于水 D.HCl气体溶于水
4.当S03晶体熔化或气化时,下述各项中发生变化的是( ) A.分子内化学键 B.分子间距离 C.分子构型 D.分子间作用力
6.下列有关共价化合物的说法:①具有较低的熔、沸点 ②不是电解质 ③固态时是分子晶体 ④都是由分子构成 ⑤液态时不导电,其中一定正确的是( ) A.①③④ B.②⑤ C.①②③④⑤ D.⑤
7.已知氯化铝的熔点为190℃(2.202×lO5Pa),但它在180℃即开始升华。 (1)氯化铝是____________。(填“离子化合物”“共价化合物”) (2)无水氯化铝在空气中强烈的“发烟”,其原因是__________________________________________________________________________________________。 (3)设计一个可靠的实验,判断氧化铝是离子化合物还是共价化合物。你设计的实验是______________________________________________。 (4)在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况时)为11.92g·L-1,试确定氯化铝在蒸气状态时的化学式为____________。
氯化铝与空气中的水蒸气发生水解反应产生HCl气体,HCl在空气中形成酸雾而“发烟”。
在其熔融状态下,试验其是否导电;若不导电是共价化合物。
1、下列物质属于分子晶体的化合物是( )A、石英 B、硫磺 C、干冰 D、食盐
2、干冰气化时,下列所述内容发生变化的是A、分子内共价键 B、分子间作用力C、分子键距离 D、分子间的氢键
3、冰醋酸固体中不存在的作用力是( )A、离子键 B、极性键 C、非极性键 D、范德华力
4、水分子间存在着氢键的作用,使水分子彼此结合而成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体,其结构如图:试分析:①1ml 冰中有 ml氢键?②H2O的熔沸点比H2S高还是低?为什么?
了解原子晶体的晶体结构模型及其性质的一般特点。理解原子晶体的晶体类型与性质的关系
原子间以共价键相结合而形成空间网状结构的晶体 ,又称共价晶体
无分子式化学式表示原子最简整数比
硼(B)、硅(Si)锗(Ge)、金刚石(C)等
SiC、BN、SiO2、Al2O3等
晶体中只存在共价键,无单个分子存在;晶体为空间网状结构。
4、原子晶体的物理性质
在SiO2晶体中,每个Si原子和( )个O原子形成( )个共价键即每个Si原子周围结合( )个O原子;同时,每个O 原子和( )个Si原子相结合。在SiO2晶体中,最小的环是( )元环。( )单个的SiO2分子存在。
第一课时 教学目标:
知道金属键的涵义能用金属键理论解释金属的物理性质能列举金属晶体的基本堆积模型了解金属晶体性质的一般特点理解金属晶体的类型与性质的关系.
金属离子与自由电子之间强烈的相互作用
金属原子的价电子发生脱落,形成金属阳离子和自由电子
自由电子被所有原子所共用从而把所有的金属原子维系在一起
金属离子与自由电子通过金属键结合而成的晶体叫做金属晶体
构成金属晶体的粒子:
常见金属晶体 :金属、合金
3、金属性质与电子气理论
电子气的运动是没有一定方向的,但在外加电场的条件下,自由电子定向运动形成电流,所以金属容易导电
自由电子在运动时与金属离子碰撞,把能量从温度高的部分传到温度低的部分,从而使整块金属达到相同的温度。
高温下热运动剧烈,因此电子的定向移动程度减弱,所以,随着温度的升高,金属的导电性减弱
金属离子和自由电子间相互作用没有方向性,在外力作用下各原子层就会发生相对滑动,但不会改变原来的排列方式,而且弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用
金属键的强弱与离子半径、离子电荷有关
④金属的熔点、硬度
金属的熔点、硬度与金属键的强弱有关
离子半径越小或离子所带电荷越多,则金属键越强,金属的熔沸点越高、硬度越大。
二、金属晶体的原子堆积模型
配位数:在晶体中与每个微粒紧密相邻 且距离相等的微粒个数
空间利用率:晶体的空间被微粒占满的体积百分数用来表示紧密堆积程度
金属的二维堆积方式
2、金属的三维堆积方式
简单立方堆积的配位数
简单立方堆积的空间占有率
②体心立方堆积(钾型)
体心立方堆积的配位数
体心立方堆积的空间占有率
c2=b2+a2
b2=a2+a2
③六方最密堆积(镁型)
六方最密堆积的配位数
六方最密堆积的空间占有率
上下面为菱形边长为半径的2倍2r
高为2倍正四面体的高
④面心立方最密堆积(铜型)
立方面心最密堆积的配位数
立方面心最密堆积的空间占有率
能说明离子键的形成,能根据离子化合物的结构特征解释其物理性质。知道离子化合物的热稳定性与阴、阳离子的半径和电荷有关。 了解晶格能的应用,知道晶格能的大小可以衡量离子晶体中离子键的强弱能说出分子晶体与原子晶体、离子晶体、金属晶体的结构基元以及物理性质方面的主要区别
由阳离子和阴离子通过离子键结合而成的晶体叫做离子晶体
无分子式化学式表示离子最简整数比
配位数(缩写为C.N.)
一个离子周围最邻近的异电性离子的数目
强碱、金属氧化物、部分盐类
每个Cl— 周围最近且等距离的Cl—有 个 每个Na+周围最近且等距离的Na+有 个
每个晶胞中Cl—有 个 Na +有 个
每个Cl— 周围最近且等距离的Cl—有 个 每个Cs+周围最近且等距离的Cs +有 个
每个晶胞中Cl—有 个 Cs +有 个
每个F— 周围最近且等距离的F—有 个 每个Ca2+周围最近且等距离的Ca2+有 个
每个晶胞中F—有 个 Ca2+有 个
3、影响离子晶体配位数的因素
①几何因素:晶体中正负离子的半径比
②电荷因素:正负离子的电荷比
③键性因素:离子键的纯粹程度
4、离子晶体的物理性质
熔沸点较高,硬度较大,难挥发难压缩。
一般易溶于水,而难溶于非极性溶剂
固态不导电,水溶液或者熔融状态下能导电
人教版 (2019)选择性必修3第四章 生物大分子第三节 核酸优质ppt课件: 这是一份人教版 (2019)选择性必修3<a href="/hx/tb_c4002479_t3/?tag_id=26" target="_blank">第四章 生物大分子第三节 核酸优质ppt课件</a>,共15页。PPT课件主要包含了核酸的组成,核酸组成,DNA,RNA,均为含氮杂环有机物,腺嘌呤核苷酸,核苷酸,核酸的结构,磷酯键,碱基间形成氢键等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修3第一节 糖类优秀ppt课件: 这是一份高中化学人教版 (2019)选择性必修3<a href="/hx/tb_c4002477_t3/?tag_id=26" target="_blank">第一节 糖类优秀ppt课件</a>,共17页。PPT课件主要包含了生活中的糖类,糖类都有甜味么,葡萄糖,麦芽糖,纤维素,糖类的组成与分类,很多糖类分子中,组成可用通式,CnH2Om,“碳水化合物”等内容,欢迎下载使用。
高中化学第四节 羧酸 羧酸衍生物完美版课件ppt: 这是一份高中化学<a href="/hx/tb_c4002471_t3/?tag_id=26" target="_blank">第四节 羧酸 羧酸衍生物完美版课件ppt</a>,共27页。PPT课件主要包含了羧酸的结构及分类,根据羧基数目,根据烃基,硬脂酸软脂酸油酸,脂肪酸,芳香酸,一元羧酸,二元羧酸,多元羧酸,低级脂肪酸等内容,欢迎下载使用。












