






2022届高三化学一轮复习 物质结构与性质知识点 课件
展开第一章:原子结构与性质
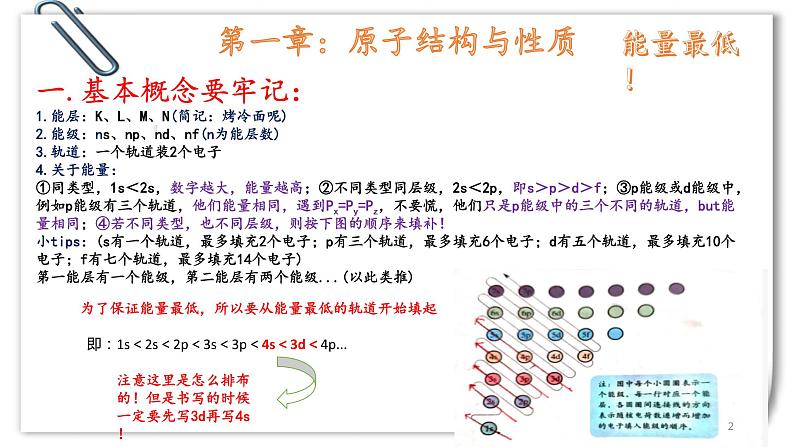
一.基本概念要牢记:1.能层:K、L、M、N(简记:烤冷面呢)2.能级:ns、np、nd、nf(n为能层数)3.轨道:一个轨道装2个电子4.关于能量:①同类型,1s<2s,数字越大,能量越高;②不同类型同层级,2s<2p,即s>p>d>f;③p能级或d能级中,例如p能级有三个轨道,他们能量相同,遇到Px=Py=Pz,不要慌,他们只是p能级中的三个不同的轨道,but能量相同;④若不同类型,也不同层级,则按下图的顺序来填补!小tips:(s有一个轨道,最多填充2个电子;p有三个轨道,最多填充6个电子;d有五个轨道,最多填充10个电子;f有七个轨道,最多填充14个电子)第一能层有一个能级,第二能层有两个能级...(以此类推)
为了保证能量最低,所以要从能量最低的轨道开始填起
即:1s<2s<2p<3s<3p<4s<3d<4p...
注意这里是怎么排布的!但是书写的时候一定要先写3d再写4s!
5.原子半径:能层越大,原子半径越大;能层相同,核电荷数越多,原子半径越小;当物质是离子时,需要另当别论...具体可以听学校老师的分析哟(选三不太考离子半径大小)6.第一电离能:气态电中性基态原子,失去第一个电子,转化为气态基态正离子所需要的最低能量7.电负性:吸引电子能力的大小(B<H<C<O)(电负性之差>1.7形成离子键,反之共价键)小tips:电负性,电离能,非金属性,大小比较都一样,一看越上面,二看越右边,最上最右它最强8.电子云轮廓:s球形;p哑铃形;d花瓣形
二、易错点:1.电离能比较中,本应N<O,但特例就是N>O。常见的有四个元素,他们比他们后一位要大为:B,N,Mg,P(简记:皮蛋没磷)2.填充电子时的注意事项:①能量最低,从能量最低的轨道开始填充,直至电子数=原子序数;②1个轨道填2个电子;③先占满轨道再填满电子;④在轨道排布图中,电子以箭头的形式表现出来,呈现一上一下两个箭头3.几种易混问法:①电子排布式:例如:1s22s22p4或[He]2s22p4;②价电子排布式:把稀有气体元素删掉,剩下的就是价电子③电子排布图r轨道排布图r轨道排布式:画框框,画箭头,在框框上写上轨道名称,例:1s,2s,重点:不要在s上再写数字4.违反泡利原理——画的两个箭头方向相同;违反洪特规则——没有先占轨道后填满;违反构造原理——没有遵循能量最低
三、小细节:1.分区:最后一个电子属于哪个轨道,就叫什么区,例如:H最后一个电子在s轨道,则属于s区2.半充满,全空,全满,能量最低最稳定!所以不会出现3d4和3d9结构,会自然变成3d5和3d10,若出现3d10结构,则该部分金属属于ds区3.对角线规则(选修三课本P20):对角线的元素,性质相似,所以找材料可以通过右下方来寻找新材料4.电离能应用:即判断元素化合价:如果某元素的In+1远大于In,则该元素的常见最高正价为+n
四、技巧:[加和法]适用题目:若要判断3d,4s,5p,4d等一系列能层的大小,可以使用这个方法步骤:令s、p、d、f分别为1、2、3、4;系数+1/2/3/4,最后得到的数字比较,谁最大,则最大。例如:3d与4s与5p与4d的比较:3d=3+3=6;4s=4+1=5;5p=5+2=7;4d=4+3=7;则:4s<3d<5p(4d),能量相同,则先排系数小的
第二章:分子结构与性质
一、基本概念要牢记:1.三大共价键:σ,π,配位键(特殊的σ键,也属于σ键的一种)2.σ键:每两个原子间形成的第一根键;两个电子形成一根σ,电子来自哪个轨道,就叫什么σ键。例如:H2,它的σ键来自于每个H的s轨道,所以它叫s-s σ键;HCl,它的σ键来自于H的s轨道和Cl的p轨道,所以它叫s-p σ键;CH4,它的C—H键,一个电子来自H的s轨道,一个电子来自C的sp3轨道,所以它叫s-sp3 σ键3.π键:除了σ键,其他全都是π键,π键不如σ键稳定,所以双键比单键容易破坏4.键参数:键能,键长,键角5.等电子体:原子总数相同,价电子总数相同的分子,具有相似的化学性质6.分子构型(选修三课本P36):课本上有很多样子,可以自己看看7.两个超重要公式(VSEPR模型):中心原子价层电子对=σ数目+孤电子对数;孤电子对计算:½(a-xb),具体内容课本P37~38有详细解析8.杂化(略):一个原子同能层轨道(能量相近)合起来重新分配电子,组成能量最低结构,轨道数就是上角标之和,注意1可以省略不写
9.配合物:把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物叫做配合物,也叫络合物;配位原子是N,把两个NH3换成了两个Cl,Cl和N都是配位原子eg:一氧化碳是共价配位键
10.正负电荷中心:正负电荷中心重合,即非极性分子,可以用向量法来推分子是否极性11.极性键:两个不同原子形成的共价键12.非极性键:两个相同原子形成的共价键13.范德华力:即:分子间的作用力;相对分子质量越大,范德华力越大;分子极性越大,范德华力越大;对物质性质的影响:①熔沸点②溶解性14.氢键:N,O,F,与H形成的作用力;氢键越多,影响越大!对物质性质的影响:分子间氢键:升高熔沸点;分子内氢键:降低熔沸点;同时与水形成分子间氢键,溶解度会上升15.相似相溶:极性溶质易溶于极性溶剂;非极性溶质易溶于非极性溶剂。16.含氧酸酸性:(HO)mROn,n越大,R的正电性越高,电离出的H+浓度越高,酸性越强
二、易错点:1.等电子体:最好能够转出自己常见的物质,左-有+,注意SiO2与CO2,即使他们同族替换,但它们不是等电子体,原因是:SiO2是共价晶体,CO2是分子晶体2.向量法一定要统一从中心原子,指向其余原子3.中心原子:一个分子中,原子数目越少,则是中心原子。特例:H2O2,把氧当做中心原子4.单质都很对称,都是非极性分子,但是O3是极性分子,原因是它形成了一个大π键5.H2CO3是弱酸,但会算出是中强酸6.只有非极性键的,不一定是非极性分子,例如臭氧;有极性键的不一定是极性分子,例如甲烷7.极性大小: 非极性共价键<极性共价键<离子键
[杂化的过程]:激发→杂化[杂化要点]:①杂化轨道数目是守恒的,参与杂化的原子轨道数等于形成的杂化轨道数;②杂化轨道只用于形成σ键;③产生的新轨道叫做杂化原子轨道[高中阶段常见杂化]:sp,sp2,sp3[杂化与结构的关系]:杂化与结构相关联,例如:sp杂化则是直线型,总结如图[杂化易错点]:①杂化出来的形状,一定要注意是否有孤电子对!!!,有孤电子对需要把孤电子对掩盖才是正确空间构型,常考:NH3,PH3:三角锥形;H2O,SO2:V形;②遇到离子,就按照正常的计算去找空间结构,一般连接四个原子的,正四面体较多;连接三个原子的,平面三角形和三角锥形最多;连接两个原子的,V形和直线形最多。
❤杂化轨道数=孤电子对数+σ
第三章:晶体结构与性质
一、基础概念要分清and细节:1.晶体:①最科学的区分晶体非晶体的方法:X-射线衍射实验;②晶胞:晶体结构的基本单元。2.四大晶体★:分子晶体、原子(共价)晶体、金属晶体、离子晶体重点:四大晶体的区分方式:①由什么粒子构成就是什么晶体;微粒间的相互作用力是什么,就是什么晶体②分子构型(画出来的结构简式)非常庞大,而且是非金属构成,就是原子晶体3.分子晶体的性质:以分子间作用力相连较典型的分子晶体:①所有非金属氢化物;②部分非金属单质,如卤素;③部分非金属氧化物;④几乎所有的酸(盐和碱离子晶体!);⑤绝大多数有机物物理共性:熔点较低,易升华,硬度较低a.不是所有分子晶体都有化学键。例如:稀有气体b.分子晶体中也可以有金属元素。例如:AlCl34.原子(共价)晶体的性质:以共价键相连较典型的原子晶体:四Si一Ge双B、CSi,SiC,Si3N4,SiO2;Ge;B,BN;金刚石,石墨烯,GeAs物理共性:高硬度,高熔点
易错点: ·题目问题为问“数目”则要带上NA
5.金属晶体的性质:以金属键相连,用这个公式去理解熔点,会很好理解哟金属键:金属阳离子与自由电子之间强烈的相互作用力,称为金属键因为金属中的自由电子被整个金属晶体共用,故金属键无饱和性和方向性物理共性:延展性,导电性,导热性,具有金属光泽(原因是金属键中的自由电子在跃迁时不吸收可见光)金属晶体的熔点比较:①金属的熔点高低与金属键的强弱直接相关②金属阳离子半径越小、离子所带电荷数越多,金属键越强③金属晶体熔点差别很大(所以一般不会拿它出来考察熔点)6.离子晶体的性质:以离子键相连(固态离子晶体也有离子!)作用力是阳阳离子间的互相吸引物理共性:①克服离子间的作用力,需要更多能量,有较高的熔沸点;②溶解性:大多溶于极性溶剂,难溶于非极性溶剂;③有较大的硬度;④离子晶体固态不导电,熔融状态或溶于水后能导电。7.晶体类型的判断方法:非金属单质+熔点高=共价晶体非金属单质+熔点低=分子晶体化合物+熔点低=分子晶体8.晶格能:气态离子形成1ml离子晶体释放的能量,通常取正值,单位:KJ/ml(与电离能相似)
·化学计量与均摊思维综合:[相同分一半,不同都计算]1mlSiO2中的共价键数目为:4NA;1ml晶体Sir1ml金刚石中的共价键数目为2NA;1ml石墨烯中的共价键数目为1.5NA
金属原子半径(r)与晶胞边长(a)的关系
在正三角形当中,做的一个垂线,垂足为重心,比例为1:2
小tips:只要形状一致,跟某些堆积方式相似,那他们的规律都是一致的,不管内部有多少杂七杂八的东西,最后规律都是具有一致性的!!!
[配位数]一个原子周围最近的其它原子的数目
1.简单立方堆积(P):
·配位数:6·一个晶胞中有一个P原子·有且仅有钋元素是这样的堆积方式·空间利用率:52%
2.体心立方堆积(K、Na、Fe等):
1被上下两层叠起来,变成了...
·配位数:8·一个晶胞里有2个原子·空间利用率:68%·碱金属等一些金属属于这种堆积方式
3.六方最密堆积(Zn、Ti、Mg):
·配位数:12·空间利用率:74%·一个晶胞中有两个原子·Zn、Ti、Mg等金属属于此类堆积方式,考试出题看到,就知道它是什么堆积
4.面心立方最密堆积(Cu、Au、Ag):
·配位数:12·空间利用率:74%·一个晶胞中有四个原子·Cu、Ag、Au等金属属于此类堆积方式,考试出题看到,就知道它是什么堆积
研究对象:面心立方最密堆积
ZnS型:八面体空隙填充率:0%四面体空隙填充率:50%
NaCl型:Cl-中填Na+八面体空隙填充率:100%四面体空隙填充率:0%配位数:Na+:6;Cl-:6
CaF2型:八面体空隙填充率:0%四面体空隙填充率:100%橙色球的配位数是4蓝绿色球的配位数是8
小结论:四个小黑球分别位于体对角线的四分之一处!
本质内涵:结构差异→性质差异→结果总结
1.半径大小比较:例如Na和F:答案:Na的核电荷数大于F(结构差异),吸电子能力大于F(性质差异),故Na的半径大于F(结果总结)2.电离能大小比较:①正常比较(例如O和F):答案:F的核电荷数大于O(结构差异),失电子能力小于O(性质差异),故F的第一电离能大于O(结果总结)②特例比较(例如N和O):答案:N的轨道为半充满结构(结构差异),N的稳定性更强/失电子能力更弱(性质差异),故N的第一电离能大于O(结果总结)3.共价键稳定性比较:★例如C—H和Si—H:答案:Si的原子半径大于C(结构差异),Si-H键长大于C-H键,所以键能小于C-H(性质差异),故Si—H的共价键没有C—H键稳定(结果总结)4.含氧酸酸性比较:具体看p75.晶格能影响因素:答案:离子半径越大,晶格能越低;离子电荷数越大,晶格能越高;6.溶解度:答案:①分子间氢键;②相似相溶,两个思考维度,直接答上去就可以了7.配位键形成的原因:答案:(两个角度)①X金属有空轨道,能接受孤电子对;②配体能提供孤电子对8.不能形成双键的原因:答案:例如:Ge原子半径大,原子间形成的σ单键较长(结构差异),p−p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键(性质差异),所以难以形成双键三键(结果总结)
第一类:晶体混杂型思考维度:不同晶体的熔沸点大小有差异;四大晶体内部熔沸点影响因素答题要点:区分好晶体类型,再进行比较不同类型晶体熔沸点;再在同晶体下答出熔沸点不同的原因满分答题:Li2O和MgO是离子晶体,P4O6和SO2是分子晶体;Li2O晶格能小于MgO,P4O6相对分子质量大于SO2(结构上),离子晶体熔沸点高于分子晶体(性质上),所以Li2O和MgO熔沸点高于P4O6和SO2且P4O6熔沸点大于SO2,Li2O熔沸点小于MgO(结果上);但其实不用这么麻烦,可以省去结果总结,因为题中问的是熔点(性质)差异的原因,只要能答到结构差异,就能推出熔沸点(性质)的差异
本质内涵:结构→性质→结果
第二类:晶体各自美丽型思考维度:是什么类型的晶体,就用对应晶体的熔沸点影响因素来作答(常考:分子晶体);关注P9~11答题要点:点出该晶体的熔沸点影响因素即可满分答题:结构相似,分子晶体(结构上),相对分子质量增大,范德华力增强(性质上),熔沸点增高(结果上)
第三类:含N,O,F元素型(考频高)思考维度:氢键影响熔沸点,具体查P6答题要点:①要答出有N,O,F(如果有具体物质则不需要写,例如NH3);②要答出分子间氢键或者分子内氢键;③答出该氢键所产生的影响满分答题:例:NH3存在分子间氢键(结构上);分子间氢键会升高熔沸点(性质上);AsH3熔沸点比NH3低(结果上)
第四类:不同种晶体间的比较思考维度:有且仅有一个:答题要点:答出各个物质的晶体类型,把“思考维度”写上去,最后得出结果满分答题:GeF3是离子晶体,GeCl3是分子晶体(结构上),离子晶体的熔沸点大于分子晶体(性质上),所以GaF3的熔沸点高(结果上)
分析题总结:①找准角度,看清楚问的是什么,本质上落脚在你学过的知识上;②答题方向永远都是从结构出发,再到性质上,看题目问的是什么,如果题目提出性质差异,那就寻找结构差异;如果题目提出结果需要你分析,那你就把结构和性质的差异都答出来。题目问什么就是什么,有时候可以省略掉性质差异,但是写上是一定不会扣分的!参考答案是给老师看的,不是给学生看的,你要答题一定还是要答得精准;③至于杂项,有非常多,是列举不完的,但是本质都是从结构出发,性质差异,再到最后结论(也就是题目);很多地方模拟题中,会出现一些拓展的作用题,开放题,例如:它可以拿来做什么东西?答案:制作火药,这就比较考察学生的开放性,以及对知识的把握程度,这两分属于开放式分数,尽可能拿下来。
在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键,或共轭大π键,简称大π键。πn m n表示P轨道数,也是成键的原子数,m表示电子数
补例1:氢原子的跃迁能量图
补例2:计算σ键的方法
1>若有结构式,就数一数相连的有多少个原子2>ABx型若给了一个化学式,就数一数中心原子周围有多少个原子,就有多少根σ键3>配位键也属于σ键哦!一定要算上!但例如NH3BH3,N的孤电子对已经给了B,所以此时,这根配位键就是这孤电子对,所以此时算杂化时,就把孤电子对算为0,N的价层电子对=σ键为3个原子+1根配位键+0个孤电子对=4,对应N元素的杂化类型为:sp3
真题闪现:补例1——2017年全国I卷:35.[化学—选修3:物质结构与性质](1分)钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为 A nm(填标号)。A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
2023届高三化学一轮复习 物质结构与性质易失分题型 课件: 这是一份2023届高三化学一轮复习 物质结构与性质易失分题型 课件,共23页。PPT课件主要包含了晶体投影问题,简单立方,六方最密,体心立方,面心立方,沿体对角线的投影,晶体缺陷问题,金刚石,①二者均属于分子晶体,①均属于分子晶体等内容,欢迎下载使用。
2022届高三化学高考备考一轮复习专题13 物质结构与性质课件: 这是一份2022届高三化学高考备考一轮复习专题13 物质结构与性质课件
2023届高三化学一轮复习 物质结构与性质(Ⅱ卷)模型构建 课件: 这是一份2023届高三化学一轮复习 物质结构与性质(Ⅱ卷)模型构建 课件,共60页。PPT课件主要包含了目录CONTENTS,命题方向,回眸高考,模型建构,考题预测,教学策略,原子结构模块,分子结构模块,晶体模块,解题模型构造等内容,欢迎下载使用。












