









- 2022—2023学年新教材高中化学鲁科版选择性必修1第2章化学反应的方向限度与速率第4节化学反应条件的优化__工业合成氨(课件+课后习题) 课件 3 次下载
- 2022—2023学年新教材高中化学鲁科版选择性必修1第3章物质在水溶液中的行为第1节水与水溶液第1课时水的电离电解质在水溶液中的存在形态(课件+课后习题) 课件 3 次下载
- 2022—2023学年新教材高中化学鲁科版选择性必修1第3章物质在水溶液中的行为第2节弱电解质的电离盐类的水解第1课时弱电解质的电离平衡(课件+课后习题) 课件 3 次下载
- 2022—2023学年新教材高中化学鲁科版选择性必修1第3章物质在水溶液中的行为第2节弱电解质的电离盐类的水解第2课时盐类的水解(课件+课后习题) 课件 3 次下载
- 2022—2023学年新教材高中化学鲁科版选择性必修1第3章物质在水溶液中的行为第2节弱电解质的电离盐类的水解第3课时盐类水解的应用(课件+课后习题) 课件 4 次下载
化学选择性必修1第1节 水与水溶液习题ppt课件
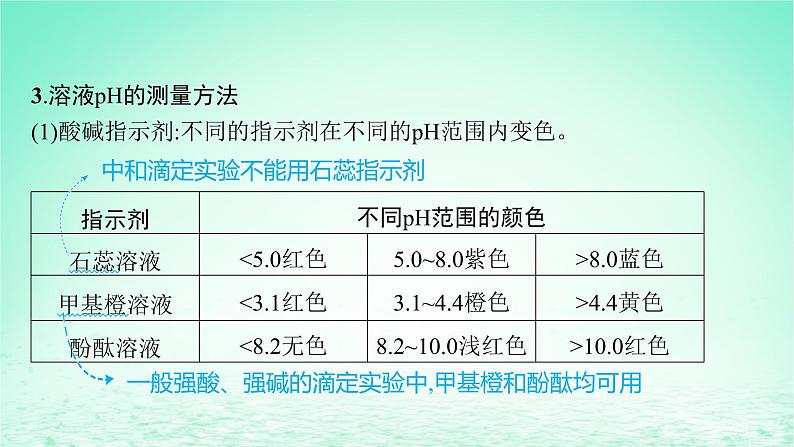
展开第2课时 水溶液的酸碱性与pH
A级 必备知识基础练
1.下列溶液一定呈酸性的是( )
A.pH<7的溶液
B.c(H+)>c(OH-)的溶液
C.含有H+的溶液
D.由水电离出的c(H+)=10-6.5 mol·L-1的溶液
2.常温下,某H2SO4溶液的浓度是0.05 mol·L-1;此溶液的pH是( )
A.1 B.2 C.5 D.6
3.下列溶液一定呈中性的是( )
A.c平(H+)=c平(OH-)=10-6 mol·L-1的溶液
B.pH=7的溶液
C.使石蕊溶液呈紫色的溶液
D.使酚酞溶液呈红色的溶液
4.下列有关水的离子积常数KW或pH变化的判断中,正确的是( )
A.随着温度的升高,水的离子积常数减小
B.随着温度的升高,纯水的pH增大
C.新制氯水光照一段时间后,pH增大
D.氢氧化钠溶液久置于空气中,pH减小
5.室温时,取浓度相同的NaOH和HCl溶液,以3∶2的体积比相混合,所得溶液的pH等于12,则原溶液的浓度均为( )
A.0.01 mol·L-1 B.0.017 mol·L-1
C.0.05 mol·L-1 D.0.50 mol·L-1
6.(2022黑龙江哈尔滨三中高二期末)25 ℃时,下列有关水的电离平衡的叙述正确的是( )
A.25 ℃与60 ℃时,水的pH相等
B.向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低
C.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
D.向水中加入少量冰醋酸,水的电离平衡逆向移动,c(H+)减小
7.室温下,有pH=12的NaOH溶液100 mL,要使它的pH降为11,回答下列问题(忽略混合后溶液体积的变化)。
(1)若加入蒸馏水,应加 mL。
(2)若加入pH为10的NaOH溶液,应加 mL。
(3)若加入0.01 mol·L-1的盐酸,应加 mL。
B级 关键能力提升练
8.室温下,关于pH=12的NaOH溶液,下列说法正确的是( )
A.溶液中c平(H+)=1.0×10-2 mol·L-1
B.溶液中由水电离出的c水(OH-)=1.0×10-2 mol·L-1
C.加水稀释到体积为原来的100倍后,溶液的pH=10
D.加入等体积pH=2的CH3COOH溶液,反应后溶液呈中性
9.(2022甘肃张掖高二期末)pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )
A.A、B两酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液强
C.a=5时,A是强酸,B是弱酸
D.若a小于5,则A、B都是弱酸,且A的酸性弱于B
10.水在几种不同温度下的电离平衡曲线如图所示。下列说法正确的是( )
A.图中对应点的温度关系为a>b>c
B.纯水仅升高温度时,可从a点变到c点
C.水的离子积常数KW数值大小关系为b>c>d
D.在b点对应温度下,0.5 mol·L-1的H2SO4溶液与1 mol·L-1的KOH溶液等体积混合,混合后c平(H+)=1×10-7 mol·L-1
11.(双选)有人曾建议用AG表示溶液的酸度,AG的定义为AG=lg。下列表述正确的是( )
A.在25 ℃时,若溶液呈中性,则pH=7,AG=0
B.在25 ℃时,若溶液呈酸性,则pH<7,AG<0
C.在25 ℃时,若溶液呈碱性,则pH>7,AG>0
D.在25 ℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
12.25 ℃时,pH=5的盐酸和pH=9的氢氧化钠溶液以体积比11∶9混合(设混合溶液体积为二者之和),混合后溶液的pH为( )
A.7.2 B.8
C.6 D.无法计算
13.室温时,下列溶液与1.0×10-5 mol·L-1的NaOH溶液的pH相同的是( )
A.把pH=6的盐酸稀释到体积为原来的1 000倍
B.把pH=10的Ba(OH)2溶液稀释到体积为原来的10倍
C.把pH=8和pH=10的NaOH溶液等体积混合
D.把pH=8的NaOH溶液稀释到体积为原来的10倍
14.(1)在温度t ℃时,某溶液中c平(H+)=1.0×10-a mol·L-1,c平(OH-)=1.0×10-b mol·L-1,已知a+b=12,则t ℃ (填“高于”“低于”或“等于”)25 ℃。
(2)室温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得混合溶液的部分pH如下表所示:
序号 | 氢氧化钡溶 液的体积/mL | 盐酸的体 积/mL | 溶液的 pH |
① | 22.00 | 0.00 | 12 |
② | 22.00 | 18.00 | 11 |
③ | 22.00 | 22.00 | 7 |
x= 。Ba(OH)2溶液的物质的量浓度为 。
(3)室温下,向100 mL pH=2的硫酸与硫酸钠的混合溶液中加入300 mL上述Ba(OH)2溶液,沉淀正好达到最大量,此时溶液的pH (填“大于”“小于”或“等于”)7;原混合溶液中硫酸钠的物质的量浓度为 。
15.已知水的电离平衡曲线如图所示,试回答下列问题:
(1)图中五点KW的关系是 。
(2)若从A点到D点,可采用的措施是 。
a.升温 b.加入少量的盐酸
c.降温 d.加入少量的NaOH
(3)E点对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为 。
C级 学科素养拔高练
16.某温度(T ℃)下的溶液中,c平(H+)=10-x mol·L-1,c平(OH-)=10-y mol·L-1,x与y的关系如图所示。请回答下列问题:
(1)此温度下,水的离子积KW= ,则该温度T ℃ (填“>”“<”或“=”)25 ℃。
(2)在此温度下,将0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
溶液 | 体积/mL | |||
甲 | 乙 | 丙 | 丁 | |
0.1 mol·L-1 Ba(OH)2 溶液 | 10 | 10 | 10 | 10 |
0.1 mol·L-1 NaHSO4 溶液 | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显 (填“酸”“碱”或“中”)性。
②写出按乙方式混合后,反应的离子方程式: 。
③按甲方式混合后,所得溶液的pH为 。
第2课时 水溶液的酸碱性与pH
A级 必备知识基础练
1.B pH<7的溶液不一定为酸性,如某温度时,水的离子积常数是10-12mol2·L-2,该温度下当pH=6时溶液呈中性,故A错误;c(H+)>c(OH-)的溶液一定呈酸性,故B正确;任何水溶液中都含有H+,无法确定溶液酸碱性,故C错误;由水电离出的c(H+)=10-6.5mol·L-1的溶液可能为中性、酸性或碱性,故D错误。
2.A 由题意可知c平(H+)=0.05 mol·L-1×2=0.1 mol·L-1,则pH=-lgc平(H+)=1。
3.A c平(H+)=c平(OH-)=10-6 mol·L-1时,溶液的pH=6,溶液一定呈中性,故A正确;pH=7的溶液不一定呈中性,如某温度时水的离子积常数是10-12 mol2·L-2,pH=6时溶液呈中性,当pH=7时溶液呈碱性,故B错误;使石蕊溶液呈紫色的溶液,常温下溶液可显酸性,故C错误;使酚酞溶液呈红色的溶液呈碱性,故D错误。
4.D 升高温度,水的电离平衡右移,KW增大,纯水中c平(H+)和c平(OH-)都变大,pH变小,A、B均错误;新制氯水在光照时发生反应2HClO2HCl+O2↑,促使平衡Cl2+H2OHCl+HClO正向移动,溶液酸性增强,则pH减小,C错误;NaOH溶液吸收空气中的CO2,溶液中c平(OH-)减小,则c平(H+)增大,所以pH减小,D正确。
5.C pH=12的溶液中c平(H+)=1×10-12 mol·L-1,设NaOH溶液和HCl溶液的浓度均为c,则混合后溶液中c平(OH-)=,所以混合溶液中c平(H+)==1.0×10-12 mol·L-1,解得:c=0.05 mol·L-1。
6.C 水的电离是吸热过程,升高温度,促进水的电离,c(H+)增大,故25 ℃与60 ℃时,水的pH不相等,A错误;向水中加入稀氨水,由于氨水电离出的OH-,导致溶液中的OH-浓度增大,水的电离平衡逆向移动,但是c(OH-)增大,B错误;向水中加入少量固体硫酸氢钠,由于NaHSO4Na++H++S,导致c平(H+)增大,KW仅仅是温度的函数,温度不变,KW不变,C正确;向水中加入少量冰醋酸,由于CH3COOHCH3COO-+H+,故水的电离平衡逆向移动,c平(H+)增大,D错误。
7.答案 (1)900 (2)1 000 (3)81.8
解析 (1)加水稀释pH=12的NaOH溶液至pH=11,可使溶液体积增大到原体积的10倍,所以需加水900 mL。
(2)设需pH=10的NaOH溶液体积为V,则:
=10-3 mol·L-1,解得V=1 L=1 000 mL。
(3)设需0.01 mol·L-1盐酸体积为V',则:
=
10-3 mol·L-1,V'≈81.8 mL。
B级 关键能力提升练
8.C pH=12的NaOH溶液,根据离子积可知,c平(H+)=1.0×10-12 mol·L-1,A不正确;溶液中由水电离出的c水(OH-)=c平(H+)=1.0×10-12 mol·L-1,B不正确;加水稀释到体积为原来的100倍后,溶液中c平(OH-)==10-4 mol·L-1,则pH=10,C正确;由于醋酸为弱酸,大部分未发生电离,反应结束后,过量的醋酸电离,使溶液呈酸性,D不正确。
9.C 1 mL pH=2的HCl溶液加水稀释到1 000 mL,pH=5。1 mL pH=2的CH3COOH溶液加水稀释到1 000 mL,2<pH<5。故当a=5时, A是强酸,B是弱酸,C项正确;当a<5时,A、B都是弱酸,且A的酸性强于B,D项错误;稀释前,两溶液pH相同,即已电离浓度相同,A酸性强于B,则A酸溶液中未电离浓度小于B,所以A溶液浓度小于B,A项错误;稀释到体积为原来的1 000倍后,A酸溶液的pH较大,溶液酸性较弱,B项错误。
10.C 水的电离是吸热过程,温度升高,水的离子积常数增大,根据图中数据得出水的离子积常数KW数值大小关系为b>c>a=d,温度关系为b>c>a=d,C项正确,A项错误;a点和c点的c平(OH-)相等,若纯水仅升高温度,c平(OH-)与c平(H+)都增大,B项错误;b点的KW=1×10-12 mol2·L-2,0.5 mol·L-1的H2SO4溶液与1 mol·L-1的KOH溶液等体积混合,充分反应后所得溶液显中性,则c平(H+)=1×10-6 mol·L-1,D项错误。
11.AD 若溶液呈中性,则c平(H+)=c平(OH-),=1,AG=0,A项正确;若溶液呈酸性,c平(H+)>c平(OH-),>1,AG>0,B项错误;若溶液呈碱性,c平(H+)<c平(OH-),<1,AG<0,C项错误;AG=lg=lgc平(H+)-lgc平(OH-),又pH=-lgc平(H+),c平(OH-)=,整理得AG=2(7-pH),D项正确。
12.C pH=5的盐酸中H+的浓度与pH=9的NaOH溶液中OH-的浓度均为1×10-5 mol·L-1,二者以体积比为11∶9 混合反应后,盐酸过量,因此反应后溶液中c溶液(H+)==1×10-6 mol·L-1,所以混合溶液pH=6。
13.B 1.0×10-5 mol·L-1的NaOH溶液的pH=9。把pH=6的盐酸稀释到体积为原来的1 000倍,pH无限接近于7;把pH=10的Ba(OH)2溶液稀释到体积为原来的10倍后,pH=9;把pH=8和pH=10的NaOH溶液等体积混合后,pH≈9.7;把pH=8的NaOH溶液稀释到体积为原来的10倍,pH接近于7。故选B。
14.答案 (1)高于
(2)2 5×10-3 mol·L-1
(3)大于 0.01 mol·L-1
解析 (1)由于a+b=12<14,所以该温度高于25 ℃。
(2)由Ba(OH)2溶液的pH=12可知Ba(OH)2溶液中c平(OH-)=1.0×10-2 mol·L-1,所以根据③计算得c(HCl)=1.0×10-2 mol·L-1,所以x=2。c[Ba(OH)2]==5×10-3 mol·L-1。
(3)n(OH-)=0.3 L×10-2 mol·L-1=3×10-3 mol,而n(H+)=1.0×10-3 mol,所以OH-剩余,溶液pH大于7,n(H2SO4)==5×10-4 mol。则n(Na2SO4)=0.3 L×5×10-3 mol·L-1-5×10-4 mol=1.0×10-3 mol,所以c(Na2SO4)==0.01 mol·L-1。
15.答案 (1)A=D=E<C<B
(2)b (3)10∶1
解析 (1)水的离子积KW随温度的升高而增大。A、D、E三点为25 ℃,B点为T ℃(高于25 ℃),C对应的点介于25 ℃与T ℃之间,故KW的关系是A=D=E<C<B。
(2)从A点至D点,保持温度不变,使c平(H+)增大,故选b。
(3)E点在25 ℃平衡曲线上,KW=1.0×10-14 mol2·L-2,由n(OH-)=n(H+)可知,V(NaOH溶液)×10-5 mol·L-1=V(H2SO4溶液)×10-4 mol·L-1,。
C级 学科素养拔高练
16.答案 (1)1×10-12 mol2·L-2 >
(2)①中 ②Ba2++OH-+H++SBaSO4↓+H2O ③11
解析 (1)KW=c平(H+)·c平(OH-)=10-x mol·L-1·10-y mol·L-1=10-(x+y) mol2·L-2,根据图示可知当x=12时,c平(OH-)=1 mol·L-1,当y=12时,c平(H+)=1 mol·L-1,故KW=1×10-12 mol2·L-2。根据温度越高水的电离程度越大,KW也随之越大,所以此时的温度大于25 ℃。
(2)①按丁方式混合时,Ba(OH)2提供的OH-与NaHSO4提供的H+的物质的量相等,混合后溶液呈中性。②按乙方式混合时,反应前n(Ba2+)=10-3 mol,n(OH-)=2×10-3 mol,n(H+)=n(S)=10-3 mol,实际反应的Ba2+、OH-、H+、S均为10-3 mol,故反应的离子方程式为Ba2++OH-+H++SBaSO4↓+H2O。③按甲方式混合时,OH-过量,反应后溶液中c平(OH-)= mol·L-1=0.1 mol·L-1,c平(H+)=10-11 mol·L-1,则pH=11。
高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第1节 水与水溶液图片ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第1节 水与水溶液图片ppt课件,共52页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,玻璃片或表面皿上,标准比色卡,答案BD,答案C,答案CD,答案D等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1节 水与水溶液教课内容课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 水与水溶液教课内容课件ppt,共43页。PPT课件主要包含了学业基础,核心素养,当堂评价,核心微网络,溶质分子或离子,溶剂分子,水合离子,水合分子,答案A,答案AD等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第1节 水与水溶液教课课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1第1节 水与水溶液教课课件ppt,共38页。PPT课件主要包含了内容索引,必备知识,自我检测,问题探究,归纳拓展,应用体验,答案D,答案C等内容,欢迎下载使用。













