






2023届高考全国通用版化学一轮考点复习10.2物质的分离、提纯、检验与鉴别课件
展开
这是一份2023届高考全国通用版化学一轮考点复习10.2物质的分离、提纯、检验与鉴别课件,共58页。PPT课件主要包含了考点一,考点二,真题演练,纯净物,固液分离,漏斗内壁,漏斗口,三层滤纸处,蒸发结晶,液体局部过热而飞溅等内容,欢迎下载使用。
考 纲要 求1. 掌握物质分离、提纯的原理和操作方法。2.掌握常见物质(离子)的检验方法。
考点一 物质的分离和提纯
基础梳理·自我排查1.物质分离和提纯(1)物质的分离将混合物的各组分分离开来,获得几种________的过程。(2)物质的提纯将混合物中的杂质除去而得到________的过程,又叫物质的净化或除杂。
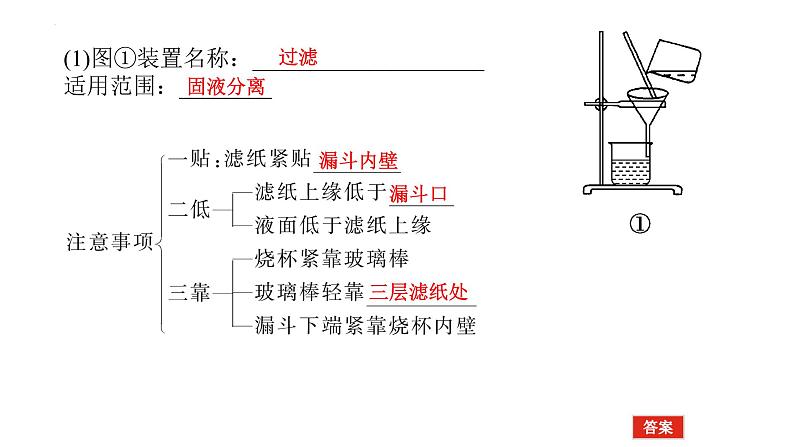
(1)图①装置名称:____________________适用范围:________
(2)图②装置名称:________适用范围:组分的溶解度受温度影响差距大的混合物分离
(5)图⑤装置名称:_______适用范围:某种组分易升华的混合物,利用物质升华的性质在加热条件下分离的方法。
3.分离提纯常用的化学方法
[思考]请选用适当的分离方法,按要求分离下列混合物
A.过滤 B.蒸发 C.萃取 D.蒸馏 E.升华 F.分液 G.重结晶 H.盐析
答案:①B ②C ③A ④E ⑤D ⑥H ⑦F ⑧G
[判断] (正确的打“√”,错误的打“×”)(1)用萃取分液的方法除去酒精中的水( )(2)升华、萃取、重结晶等操作和物质的溶解度无关( )(3)分液操作中,待下层液体流出后,再将上层液体从分液漏斗的下口放出( )(4)蒸发操作中,将蒸发皿放在三脚架上,并垫上石棉网加热( )(5)过滤时为加快过滤,用玻璃棒搅拌悬浊液( )(6)蒸发时可用玻璃棒搅拌( )(7)提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法( )(8)NaCl的熔点高,除去碘中的NaCl应采用加热升华的方法( )
微点拨 提纯的“四个原则”及“四个必须”(1)“四个原则”:一是不增加新的杂质;二是不减少被提纯物质;三是被提纯物质与杂质易分离;四是被提纯物质易复原。(2)“四个必须”:一是除杂试剂必须过量;二是过量试剂必须除尽;三是除杂途径必须最佳;四是除去多种杂质时必须考虑加入试剂的先后顺序。
考点专练·层级突破练点一 仪器、试剂、方法的选择1.下列实验中,所采取的分离方法与对应原理都正确的是( )
解析:除去KCl中的MnO2应采用过滤的方法;B项,碘易升华,加热可分离;C项,利用重结晶方法分离KNO3和NaCl是利用KNO3的溶解度受温度的影响大于NaCl;D项,食用油和汽油互溶,但沸点不同应用蒸馏的方法分离。
练点二 分离提纯装置的判断2.实验室提纯含少量氯化钠杂质的硝酸钾的过程如图所示。下列分析正确的是( ) A.操作Ⅰ是过滤,将固体分离除去B.操作Ⅱ是加热浓缩,趁热过滤,除去杂质氯化钠C.操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来D.操作Ⅰ~Ⅲ总共需两次过滤
解析:操作Ⅰ应是溶解,A项错误;操作Ⅱ应是加热浓缩,冷却结晶,使KNO3晶体析出,B项错误;C项正确;操作Ⅰ~Ⅲ只过滤一次,D项错误。
3.从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是( )
解析:A项,在坩埚中灼烧,错误;B项,过滤时应该用玻璃棒引流,错误;C项,由于碘的CCl4溶液的密度比水大,而且与水互不相溶,所以分离互不相溶的两层液体应该用分液的方法,正确;D项,蒸馏时温度计的水银球应放在蒸馏烧瓶的支管口附近,不能伸入到液面以下,错误。
4.下列实验的试剂、装置选用不合理的是( )
解析:A选项合理,甲装置中饱和氯化钠溶液可除去HCl,浓硫酸可除去H2O;B选项不合理,干燥管中的无水氯化钙在除去水的同时也吸收NH3;C选项合理,干燥管中的碱石灰的主要成分为生石灰与氢氧化钠,可除去HCl和H2O;D选项合理,在加热条件下,O2可与丙装置中的铜网反应而被除去。
练点三 流程分析中的分离提纯5.青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157 ℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35 ℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:
(1)对青蒿进行干燥破碎的目的是_____________________________________________。(2)操作Ⅰ需要的玻璃仪器主要有烧杯、___________,操作Ⅱ的名称是________。(3)操作Ⅲ的主要过程可能是____ (填字母)。A.加水溶解,蒸发浓缩、冷却结晶B.加95%的乙醇,浓缩、结晶、过滤C.加入乙醚进行萃取分液
增大青蒿与乙醚的接触面积,提高青蒿素的浸出率
6.工业品MnCl2溶液中含有杂质,利用锰粉、草酸、硫酸锰分别依次除去Pb2+、Ca2+、Mg2+制得纯净的MnCl2。工艺流程如下: 已知:①草酸为二元弱酸,其钠盐、钾盐易溶于水,钙盐难溶于水。②硫酸镁晶体、硫酸锰的溶解度曲线如图:
回答下列问题:(1)过滤所需的玻璃仪器主要有_________________,加热搅拌的作用是______________。(2)弃渣Ⅰ、Ⅱ、Ⅲ的主要成分分别为____________、___________、________________。反应①的离子方程式为____________________。(3)反应②的离子方程式为_______________________________。
硫酸钡(或BaSO4)
Mn+Pb2+===Mn2++Pb
H2C2O4+Ca2+===CaC2O4↓+2H+
解析:(1)过滤所需的玻璃仪器主要有漏斗、烧杯、玻璃棒,加热搅拌的作用是加快反应速率。(2)根据题意,结合流程图知,反应①为除Pb2+,则弃渣Ⅰ为铅及少量锰粉;反应③除镁离子,则弃渣Ⅱ为硫酸镁晶体;反应④为除去引入的硫酸根离子,则弃渣Ⅲ为硫酸钡。(3)草酸与Ca2+反应生成草酸钙沉淀,注意草酸为弱酸,不能拆写成离子。
(4)③加热搅拌、静置过滤时,所选择的温度的范围是________。a.0~20 ℃ b.20~40 ℃c.40~60 ℃ d.80~90 ℃(5)④加入氯化钡溶液主要是为了除去________,检验该离子是否除尽的方法为_______________________________________________________________________________。(6)已知MnCl2溶液呈弱酸性,操作X为___ (填字母)。a.蒸发结晶 b.降温结晶c.萃取分液 d.蒸馏
解析: (4)根据硫酸锰与硫酸镁晶体的溶解度曲线,可知在80~90 ℃的范围内二者溶解度差别最大,且硫酸镁晶体的溶解度最小。(6)MnCl2溶液呈弱酸性,是因为Mn2+水解,不能用蒸发结晶的方法,而用蒸发浓缩、冷却结晶(即降温结晶)的方法。
考点二 物质的检验与鉴别
基础梳理·自我排查1.常见离子的检验方法
2.常见气体的检验(1)可燃性气体的检验
(2)酸性气体的检验
继续通入浑浊的石灰水再变澄清
(3)碱性气体(NH3)的检验
(4)强氧化性气体的检验
(5)NO的检验——无色气体,打开瓶口与空气接触后气体立即变为________色。
(5)将某气体与湿润的红色石蕊试纸接触,试纸变蓝色,则该气体中一定含有NH3( )(6)能使品红溶液褪色的气体一定是SO2( )(7)将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯( )(8)某气体能使湿润的淀粉碘化钾试纸变蓝,该气体一定是氯气( )(9)某气体在空气中可产生白雾,且能使湿润的蓝色试纸变红,则该气体一定是HCl( )
4.下列实验可实现鉴别目的的是( )A.用BaCl2溶液鉴别SO3(g)和SO2B.用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液C.用CO2鉴别NaAlO2溶液和Na2SiO3溶液D.用酚酞鉴别盐酸和氯化钠溶液
解析:BaCl2溶液与SO3(g)反应生成硫酸钡沉淀,与SO2不反应,A项正确;Ca(OH)2溶液与Na2CO3、NaHCO3溶液都反应生成碳酸钙沉淀,B项不能达到鉴别目的;CO2与NaAlO2溶液和Na2SiO3溶液反应分别生成白色的氢氧化铝沉淀和白色的硅酸沉淀,C项不能达到鉴别目的;酚酞遇碱变红色,在酸性或中性溶液中不变色,因此D项不能达到鉴别目的。
1.[2021·湖南卷,3]下列实验设计不能达到实验目的的是( )
解析:向待测液中滴加KSCN溶液,溶液若变成血红色,说明存在Fe3+,证明FeSO4被氧化,可以达到实验目的,A不符合题意;实验室利用二氧化锰与浓盐酸反应制备氯气,所得气体中含有HCl,故先将所得气体通入饱和食盐水中,除去HCl,再经过浓硫酸干燥,可得纯净、干燥的氯气,可以达到实验目的,B不符合题意;测定NaOH溶液的pH时,pH试纸不能润湿,否则会稀释待测液,使溶液碱性减弱,测得的pH偏小,不能达到实验目的,C符合题意;工业酒精中含有水,先加入生石灰除去水分,再进行蒸馏,可制备无水乙醇,可以达到实验目的,D不符合题意。
2.[2020·全国卷Ⅰ,9]下列气体去除杂质的方法中,不能实现目的的是( )
解析:A项,二氧化硫也有较强的还原性,也能被酸性高锰酸钾溶液氧化,不能实现除杂目的;B项,饱和的食盐水可以除去氯气中的氯化氢气体,同时可以降低氯气的溶解度,能达到除杂的目的;C项,杂质氧气会与灼热的铜丝反应,生成氧化铜固体,而氮气不会与铜反应,能达到除杂的目的;D项,混合气体通过氢氧化钠溶液,NO不与氢氧化钠溶液反应,而NO2会与氢氧化钠溶液反应生成硝酸钠、亚硝酸钠和水,能达到除杂的目的。
4.[2020·山东卷,8]实验室分离Fe3+和Al3+的流程如下: 已知Fe3+在浓盐酸中生成黄色配离子[FeCl4]-,该配离子在乙醚(Et2O,沸点34.6 ℃)中生成缔合物Et2O·H+·[FeCl4]-。下列说法错误的是( )A.萃取振荡时,分液漏斗下口应倾斜向下B.分液时,应先将下层液体由分液漏斗下口放出C.分液后水相为无色,说明已达到分离目的D.蒸馏时选用直形冷凝管
解析:萃取振荡时,应盖上分液漏斗上方的瓶塞子,关闭旋塞,将分液漏斗下口倾斜向上,A项错误;液体分层后,先将下层液体由分液漏斗下口放出,关闭旋塞,再从上口倒出上层液体,B项正确;加入乙醚萃取后,Fe3+完全转化为Et2O·H+·[FeCl4]-,则分液后水相为无色,说明已达到分离目的,C项正确;蒸馏时选用直形冷凝管,便于馏分流出,D项正确。
5.[2020·天津卷,6]检验下列物质所选用的试剂正确的是( )
解析:本题考查物质的检验,考查的化学学科核心素养是科学探究与创新意识。淀粉遇碘单质变蓝色,而海水中的碘以离子形式存在,A项错误;CO2和SO2与澄清石灰水反应现象相同,B项错误;向含Cu2+的溶液中滴加氨水可以产生蓝色沉淀,继续滴加氨水,沉淀溶解,C项正确;检验氨气应用湿润的红色石蕊试纸,D项错误。
6.[江苏卷]下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( )
A.用装置甲灼烧碎海带B.用装置乙过滤海带灰的浸泡液C.用装置丙制备用于氧化浸泡液中I-的Cl2D.用装置丁吸收氧化浸泡液中I-后的Cl2尾气
解析:灼烧应在坩埚中进行,A项错误;海带灰浸泡液通过过滤可得海带灰和滤液,B项正确;浓HCl与MnO2反应制备Cl2时需要加热,C项错误;Cl2在饱和NaCl溶液中的溶解度小,应用碱液吸收,D项错误。
相关课件
这是一份2024届高考化学一轮复习物质的分离和提纯、检验和鉴别课件,共60页。PPT课件主要包含了知识梳理,夯实必备知识,难溶固体,大量晶体,降温结晶,支管口,溶解度,不互溶,提升关键能力,蒸发浓缩等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习10.2物质的分离提纯检验与鉴别课件
这是一份10.2物质的分离、提纯、检验与鉴别,共59页。PPT课件主要包含了考点一,考点二,真题演练,纯净物,固液分离,漏斗内壁,漏斗口,三层滤纸处,蒸发结晶,液体局部过热而飞溅等内容,欢迎下载使用。








