






高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率图片课件ppt
展开问题:为什么要研究化学反应速率
表示方法:单位时间内反应物浓度的减少或生成物浓度的增大。
任务一:如何表示化学反应的快慢?
公式含义:某一时间内化学反应的平均速率。
ml /(L·s)
或 ml·L-1·S-1
mA + nB = pC + qD
分别用一种物质的浓度随时间变化来表示化学反应速率
注意:用浓度变化表示化学反应速率适用于气体和溶液中的溶质,不适用于固体和纯液体。
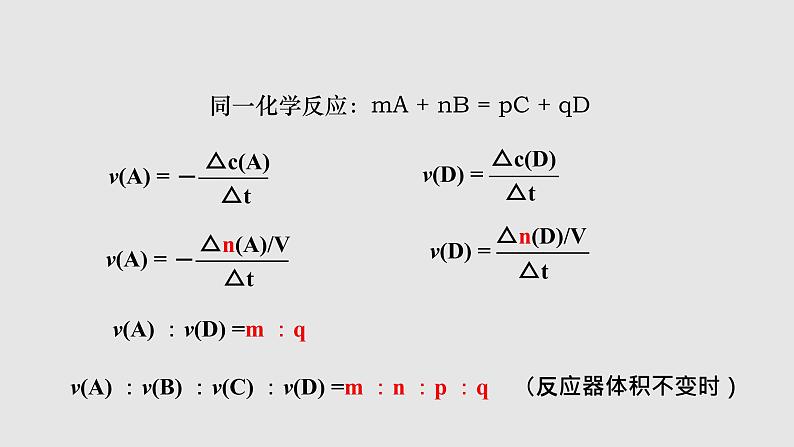
同一化学反应:mA + nB = pC + qD
v(A) :v(D) =m :q
v(A) :v(B) :v(C) :v(D) =m :n :p :q (反应器体积不变时)
例:在密闭容器中合成氨的反应: N2+3H2 2NH3,反应开始时N2的浓度为4ml/L,H2的浓度变为12 ml/L,5min后N2的浓度为3ml/L,用N2的浓度变化表示该化学反应速率。
任务二:定量描述化学反应的快慢
△c(N2) = 3ml/L-4ml/L = -1ml/L
v(N2) = 0.2ml/(L·ml)
N2+3H2 2NH3
v(H2) = 3 v(N2)
v(NH3) = 2v(N2)
v(H2) = 0.6ml/(L·min)
v(NH3) = 0.4ml/(L·min)
v(A) :v(B) :v(C) :v(D) = m :n :p :q
思考:如何比较化学反应速率的大小?
(1)换算成同一单位表示。
(2)比较化学反应速率与化学计量数的比值。
不同条件下:mA + nB = pC + qD
例:在密闭容器中合成氨的反应: N2+3H2 2NH3,反应开始时,在不同反应条件下测得化学反应速率如下,其中化学反应速率最小的是( )
A. v(N2) = 0.6 ml/(L·min)
B. v(H2) = 1.2 ml/(L·min)
C. v(NH3) = 1.2 ml/(L·min)
任务三:如何测定化学反应?
找与化学反应物质的浓度相关的物理量。
找与该物理量化学变化对应的时间。
选择可观测、易操作的变量
测量化学反应速率的常见方法:1、量气法 2、比色法 3、电导法 4、激光技术法
例:在一定温度下,10mL 0.4ml/L H2O2溶液发生催化分解。测定 0~6min内的化学反应速率。
2H2O2 2H2O2 + O2↑
例:在一定温度下,10mL 0.4ml/L H2O2溶液发生催化分解。不同时刻测得生成的O2的体积(已折算为标准状况)如表所示(溶液体积变化忽略不计)。0~6min求时段的化学反应速率。
△n /(ml/L) -2.0×10-3 1.0×10-3
-————— =
△n(H2O2 ) V·△t
-2.0×10-3 0.01L×6min
-—————— ≈ 3.3×10-3 ml/(L·min)
任务四:如何用实验法比较化学反应速率大小?
你有哪些方法比较锌粒和1ml/L H2SO4溶液、4ml/L H2SO4溶液化学反应速率大小?
定性描述:生成物快慢,反应物变化快慢
定量测定:生成物快慢,反应物变化快慢
Zn + H2SO4 = ZnSO4 + H2↑
c (H+) 、 c (Zn2+) 、V(H2) 、m(Zn)
1、确定变量:硫酸的浓度
反应物:锌粒的表面积、锌粒的质量
2、控制不变的因素:锌粒的表面积、锌粒的质量、溶液的体积、 温度、压强3、测定数据 a. 固定体积测时间? b. 固定时间测体积?
基于变量控制法测定化学反应速率的思路
测定某条件下的化学反应速率
选择可观测,易操作的变量
测量与反应物浓度相关的物理量
人教版 (2019)选择性必修1第一节 化学反应速率优秀课件ppt: 这是一份人教版 (2019)选择性必修1第一节 化学反应速率优秀课件ppt,共24页。PPT课件主要包含了学习目标,内因主要因素,注意以下两种情况,产生气泡速率较慢,产生气泡速率较快,产生气泡速率很慢,△HE-E,活化能,基元反应等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率精品ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率精品ppt课件,共21页。PPT课件主要包含了∶1∶2,化学计量数之比,物质的量变化量之比,均取正直等内容,欢迎下载使用。
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率课文内容ppt课件: 这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率课文内容ppt课件,共30页。PPT课件主要包含了学习目标,情景导学,问题导学,知识回顾,浓度对反应速率的影响,实验探究,实验结论,注意事项,温馨提醒,压强对反应速率的影响等内容,欢迎下载使用。













