




- 专题15 沉淀的溶解平衡 (4)- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题01 电离平衡 (电解质的分类) - 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题03 电离平衡 (电离平衡常数)- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题04 水的电离和溶液的pH- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题06 酸碱中和滴定- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 2 次下载
人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡优秀ppt课件
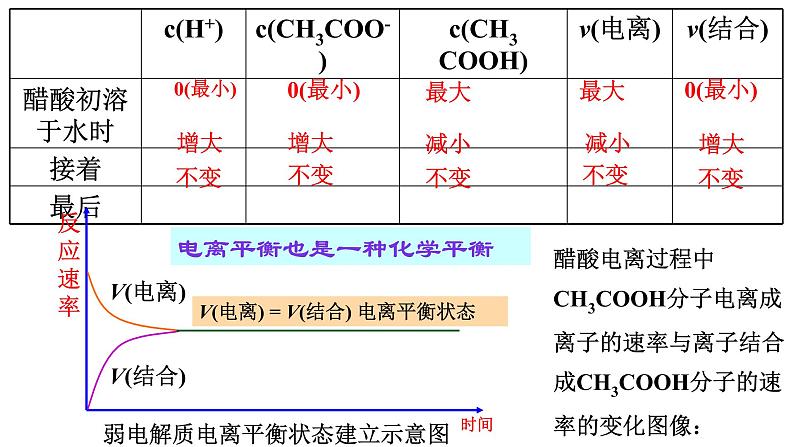
展开【思考】在一定的条件下,往一杯水中加进一定量的冰醋酸会发生如何的变化?
V(电离) = V(结合) 电离平衡状态
弱电解质电离平衡状态建立示意图
醋酸电离过程中CH3COOH分子电离成离子的速率与离子结合成CH3COOH分子的速率的变化图像:
电离平衡也是一种化学平衡
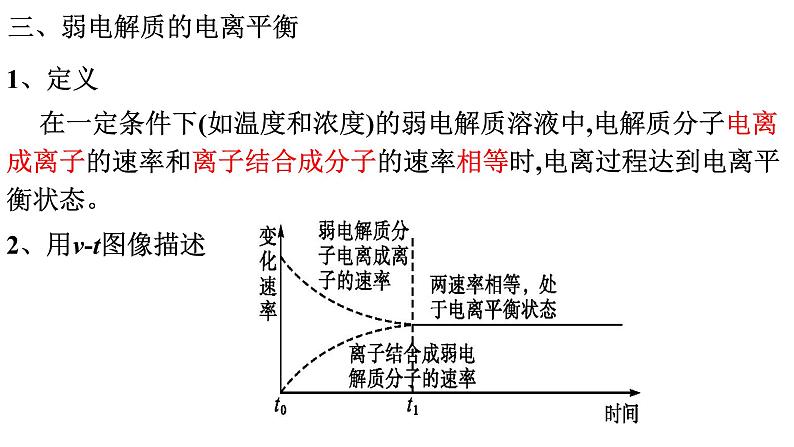
在一定条件下(如温度和浓度)的弱电解质溶液中,电解质分子电离成离子的速率和离子结合成分子的速率相等时,电离过程达到电离平衡状态。
三、弱电解质的电离平衡
3、电离平衡的特点 ①电离过程是吸热的。 ②弱电解质的电离属于可逆过程,分子、离子共存 ③弱电解质在溶液中的电离都是微弱的。 如0.1 ml·L-1的CH3COOH溶液中,c(H+)在1×10-3 ml·L-1左右。电离方向是微粒数增多的过程.
弱电解质的电离是可逆过程
v(电离) = v(结合) ≠0
电离平衡是一种动态平衡
溶液中各分子、离子的浓度不变。
条件改变时,电离平衡发生移动
平衡移动规律—勒夏特列原理
5、影响电离平衡的因素
内因:电解质本身的性质。通常电解质越弱电离程度越小。
当外界条件改变时符合“勒夏特列原理”
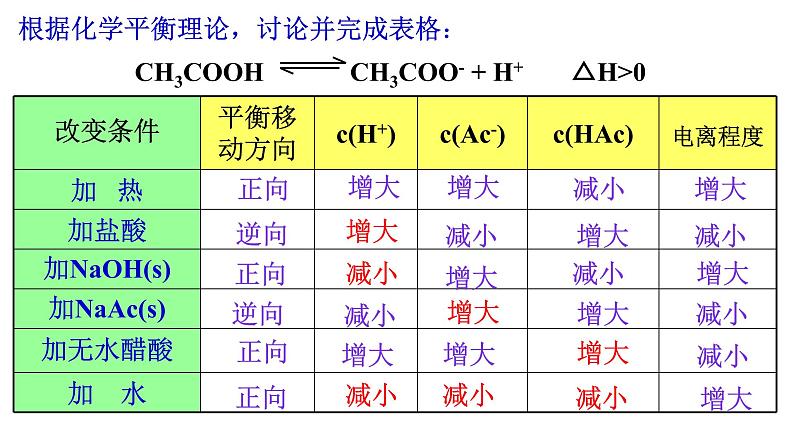
根据化学平衡理论,讨论并完成表格:
规律:由于电离过程吸热,升高温度,电离平衡向电离的方向移动,电离程度增大; 降低温度,电离平衡向逆反应方向移动,电离程度减小。
【特别注意】 易挥发或易分解的弱电解质的电离平衡,温度过高,使分子浓度减小,平衡向逆向移动。
规律:电解质溶液的浓度越小,它的电离程度就越大。
实验测得:用水稀释冰醋酸时氢离子浓度随加水量的变化曲线
①加水稀释向电离的方向移动,电离程度增大,但离子浓度减小 ②增加弱电解质浓度,向电离的方向移动,但电离程度减小 ③加入同浓度的弱电解质溶液→平衡不移动→各微粒浓度不变、电离程度不变
①加入同弱电解质具有相同离子的强电解质,抑制了弱电解质的电离,使电离平衡向逆反应方向移动,电离程度减小; ②加入能与弱电解质电离产生的某种离子反应的物质时,减少了该离子的浓度,促进了弱电解质的电离,使电离平衡向电离方向(即正反应方向)移动,电离程度增大。
1.(2015·海淀区)稀氨水中存在着下列平衡:NH3·H2O NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是 ( ) ①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体 A.①②③⑤ B.③⑥ C.③ D.③⑤
2、0.1 ml·L-1CH3COOH溶液中存在电离平衡:CH3COOH H+ + CH3COO- 。加水稀释或加入少量CH3COONa晶体时,都会引起( ) A.溶液的酸性减弱 B.CH3COOH电离程度变大 C.溶液的导电能力减弱 D.溶液中c(CH3COO-)减小 E.溶液中醋酸分子减少
3、现有两瓶醋酸溶液,其物质的量浓度分别为1ml/L和 0.1 ml/L,那么这两瓶溶液的氢离子浓度的比值是大于10、小于10、还是等于10 ?
小于10。若电离程度相同,则两瓶氢离子浓度比值刚好为10,但事实上浓溶液的电离度较小,所以浓度的比值小于10。
(7)若使c点溶液的c(CH3COO-)增大,溶液的pH也增大,可采取的措施为: 。 A.加盐酸 B.加冰醋酸 C.加入固体KOH D.加水 E.加固体CH3COONa F.加Zn粒
4、向冰醋酸中逐滴加水,导电能力随加水体积的变化曲线如下。研究图中a、b、c三点,探究如下问题:电离程度最大的点是 。n(H+)最大 。(3)c(H+)最大 。 (4)pH最大 。(5)b点以后,c(H+)和c(HAc)比值怎样变化 。 (6)b、c两点Ka大小关系 。
(8)a、b、c三点中和氢氧化钠的能力_______
试用简单的实验证明在醋酸溶液中存在着CH3COOH H+ + CH3COO-的电离平衡(要求写出简要操作、实验现象及实验能说明的问题)。
在醋酸溶液中滴入石蕊溶液,溶液呈红色,加热溶液颜色明显变深。说明加热能促进醋酸的电离,c(H+)增大,红色加深。即可证明醋酸溶液中存在电离平衡。
人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素集体备课ppt课件: 这是一份人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素集体备课ppt课件,共16页。PPT课件主要包含了沉淀溶解平衡实验,沉淀溶解平衡图像,NaHCO3,46×10-6等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素课前预习ppt课件: 这是一份高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素课前预习ppt课件,共28页。PPT课件主要包含了沉淀的生成,1原则,3方法,同离子效应法,思考与交流,沉淀的溶解,1原理,2举例,+H+,迅速溶解等内容,欢迎下载使用。
2021学年实验活动1 探究影响化学平衡移动的因素图文课件ppt: 这是一份2021学年实验活动1 探究影响化学平衡移动的因素图文课件ppt,共12页。PPT课件主要包含了②溶度积规则,①离子积等内容,欢迎下载使用。













