


- 专题05 pH值的计算- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题13 沉淀的溶解平衡 (2)- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题14 沉淀的溶解平衡 (3)- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题15 沉淀的溶解平衡 (4)- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题01 电离平衡 (电解质的分类) - 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素图片ppt课件
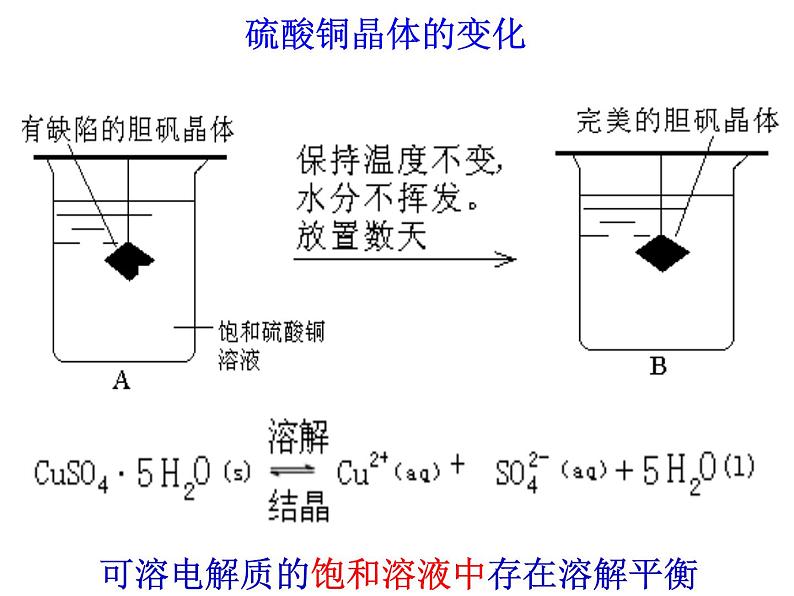
展开可溶电解质的饱和溶液中存在溶解平衡
可溶电解质的饱和溶液中存在溶解平衡,难溶的电解质在水中是否也存在溶解平衡呢?
我们知道,溶液中有难溶于水的沉淀生成是离子反应发生的条件之一。例如,AgNO3溶液与NaCl溶液混合,生成白色沉淀AgCl:Ag+ +Cl- =AgCl↓,如果上述两种溶液是等物质的量浓度、等体积的,一般认为反应可以进行到底。
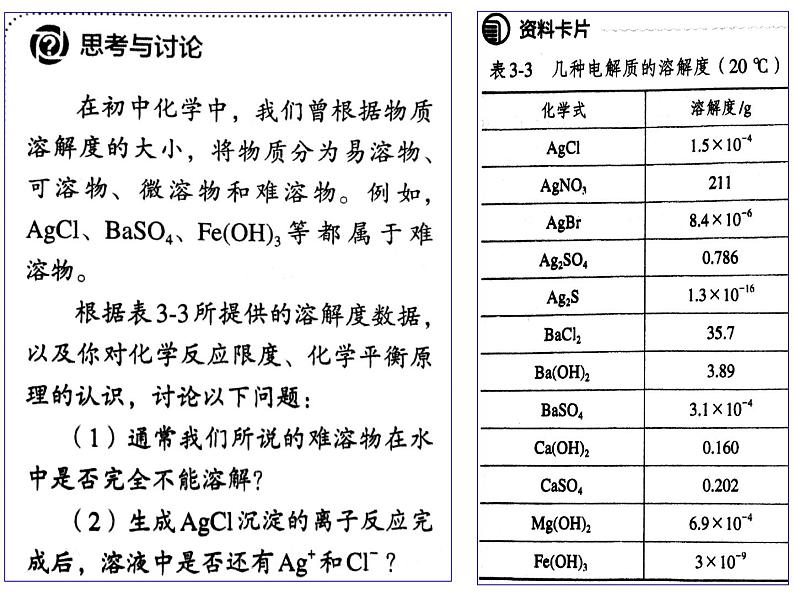
【思考与讨论】Ag+和Cl-的反应真能进行到底吗?即溶液中还有Ag+和Cl-吗?
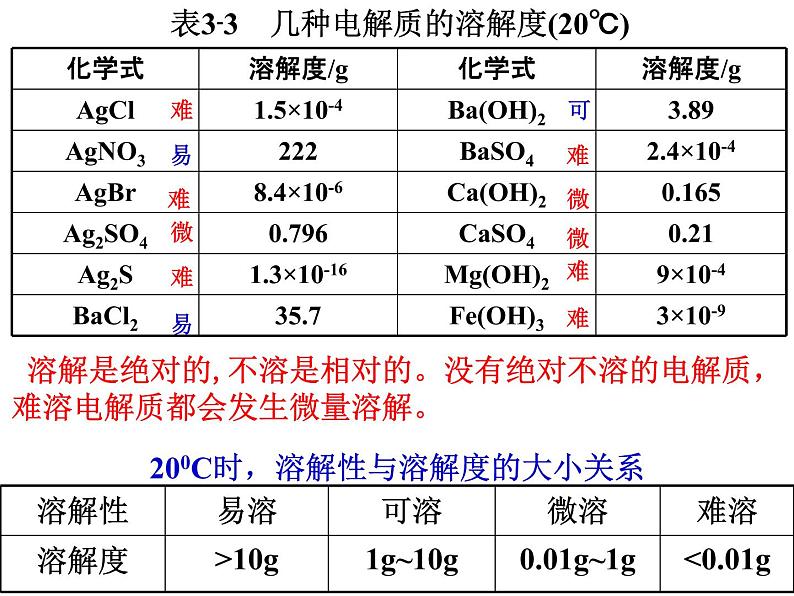
表3-3 几种电解质的溶解度(20℃)
200C时,溶解性与溶解度的大小关系
溶解是绝对的,不溶是相对的。没有绝对不溶的电解质,难溶电解质都会发生微量溶解。
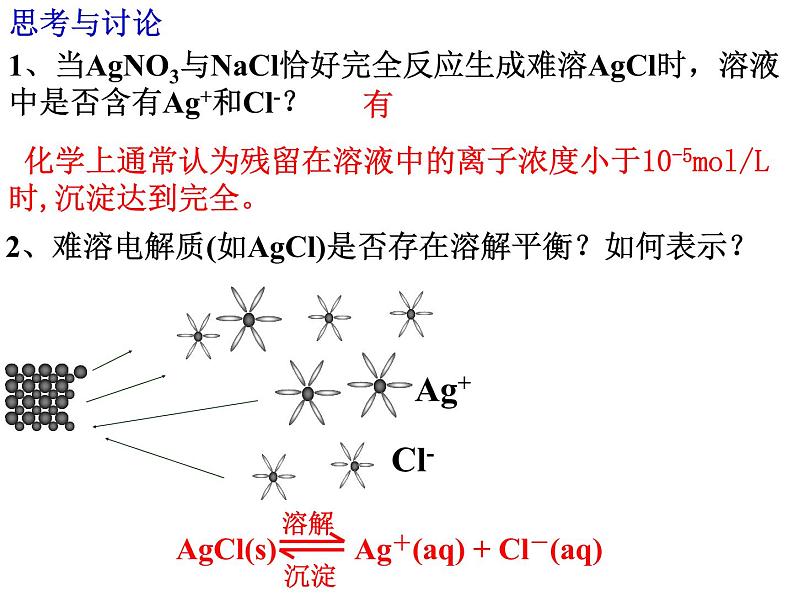
1、当AgNO3与NaCl恰好完全反应生成难溶AgCl时,溶液中是否含有Ag+和Cl-?
2、难溶电解质(如AgCl)是否存在溶解平衡?如何表示?
化学上通常认为残留在溶液中的离子浓度小于10-5ml/L时,沉淀达到完全。
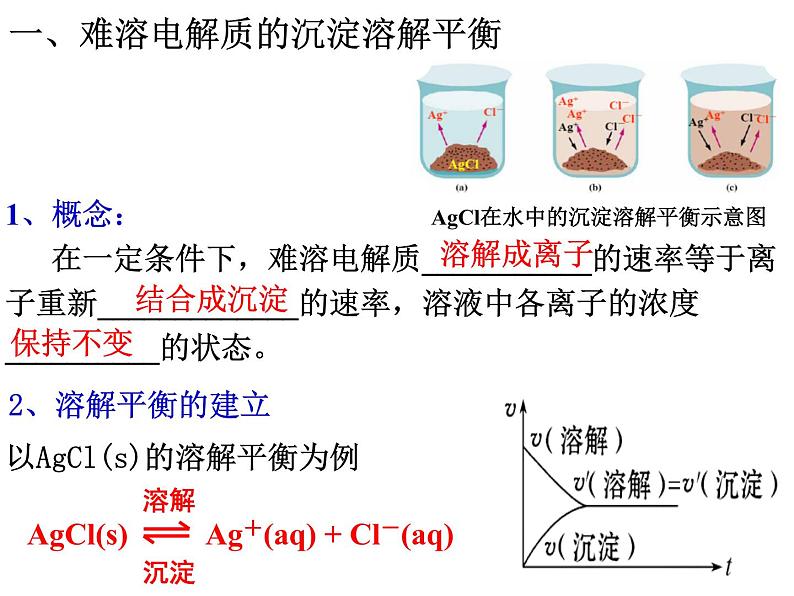
1、概念: 在一定条件下,难溶电解质___________的速率等于离子重新_____________的速率,溶液中各离子的浓度__________的状态。
以AgCl(s)的溶解平衡为例
溶解 AgCl(s) Ag+(aq) + Cl-(aq) 沉淀
一、难溶电解质的沉淀溶解平衡
练:书写AgI、Mg(OH)2溶解平衡的表达式
【提醒】①须标明状态(s)、(aq), ②一律用“ ⇌”。
【说明】沉淀溶解平衡与难溶电解质的电离
⇌ Ba2+(aq)+SO42-(aq) 包含了BaSO4(s) ⇌BaSO4(aq)和 BaSO4=Ba2++SO42-
⇌Al3+(aq)+3OH-(aq) Al(OH)3 ⇌Al3++3OH-
Al(OH)3(s)
【注意】在电解质的溶液中,不管是易溶的、微溶的、难溶的电解质都存在着溶解平衡。
既然沉淀存在溶解平衡,为什么通常情况下,可以认为生成沉淀的反应可以进行到底呢?
化学上通常认为残留在溶液中的离子浓度小于10-5ml/L时,沉淀达到完全。
→ ↑ ↑
→ 不变 不变
不移动 不变 不变
← ↓ ↑
→ ↓ ↑
← ↑ ↓
5、影响沉淀溶解平衡的因素:
同是难溶电解质,溶解度差别也很大
①内因:电解质本身的性质
a.浓度:加水,平衡向溶解方向移动。
b.温度:升温,多数平衡向溶解方向移动。
c.与难溶电解质构成粒子相同的物质——同离子效应
d.与难溶电解质溶解所得的离子能反应的物质
Ca(OH)2等少量物质的溶解度随温度的升高而减小。
例题1、有关AgCl沉淀的溶解平衡说法正确的是( ) A. AgCl沉淀生成和沉淀溶解不断进行,但速率相等 B. AgCl难溶于水,溶液中没有Ag+和Cl- C. 升高温度,AgCl沉淀的溶解度增大 D. 向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变例题2、石灰乳中存在下列平衡: Ca(OH)2(s) Ca2+(aq)+2OH-(aq),加入下列溶液或进行如下操作,可使Ca(OH)2减少的是 ( ) A、Na2CO3溶液 B、AlCl3溶液 C、NaOH溶液 D、CaCl2溶液 E、升高温度 G、加水
追问:加水,达到平衡后溶液中Ca2+、OH-浓度如何变化?
例3.将足量的AgCl分别放入: (1)5mL水 (2)10mL 0.2mlL-1 MgCl2溶液 (3)20mL 0.5mlL-1 NaCl溶液 (4)40mL 0.1mlL-1盐酸 (5)10mL 0.1mlL-1AgNO3溶液 (6) 10mL 0.1mlL-1NaNO3溶液中溶解至饱和,各溶液中Ag+浓度由大到小的顺序为: 。
(5)>(1)= (6) >(4)>(2)>(3)
在一定温度下,在难溶电解质的饱和溶液中,各离子浓度幂之积为一常数,叫做溶度积常数,简称溶度积,用Ksp表示。
Ksp(AmBn)= cm (An+) . cn (Bm-)
注意:Ksp只与电解质本身的性质和温度有关,与浓度无关!!!
例1:写出下列难溶电解质的溶解平衡关系式和溶度积表达式。
AgBr(s) ⇌ Ag+(aq) + Br-(aq)
Ksp = c(Ag+) . c(Br-)
Fe(OH)3(s) ⇌ Fe3+(aq) + 3OH-(aq)
Ksp = c(Fe3+) . c3(OH-)
Ag2CrO4 (s) ⇌ 2Ag+ (aq) + CrO4 2-(aq)
Ksp = c2(Ag+) . c(CrO42-)
几种难溶电解质的溶度积(25C)
3.Ksp的意义 Ksp反映了难溶电解质在水中的溶解能力。
定性比较,感受溶度积与难溶物的溶解能力之间的关系?
课堂练习1、在含有大量PbI2的饱和溶液中存在着平衡:PbI2(s) ⇌Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是 ( ) A.溶液中Pb2+和I-浓度都增大 B.溶度积常数Ksp增大 C.沉淀溶解平衡向右移动 D.溶液中Pb2+浓度减小
2、室温下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) ⇌ Ca2+ (aq) +2OH- (aq) ,当向一定量的石灰乳悬浊液中加入少量生石灰时(恢复到室温),下列说法正确的是 ( ) A.溶液中Ca2+离子数目减少 B.溶液中C(Ca2+)增大 C.溶液的pH增大 D.溶液中溶质的质量分数增大
①对于同类型物质,Ksp数值越大,难溶电解质在水中的溶解能越强。如由Ksp数值可知(P65),溶解能力: AgCl AgBr AgI Ag2SO4 Ag2CrO4
② 不同类型的物质,Ksp差距不大时不能直接作为比较依据,需通过计算才能比较。如某温度下: AgCl(s) Ag+(aq)+Cl-(aq), Ksp=1.8×10-10Mg(OH)2(s) Mg2+(aq)+2OH-(aq),Ksp=5.6×10-12
虽然Mg(OH)2的Ksp较小,但不能认为Mg(OH)2比AgCl更难溶。 一般比较难溶物质,往往比较的是饱和溶液中溶质的物质的量浓度。 此温度下,AgCl的浓度约1.3×10-5ml·L-1,Mg(OH)2约1.2×10-4ml·L-1,显然Mg(OH)2更易溶解。
人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素集体备课ppt课件: 这是一份人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素集体备课ppt课件,共16页。PPT课件主要包含了沉淀溶解平衡实验,沉淀溶解平衡图像,NaHCO3,46×10-6等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素课前预习ppt课件: 这是一份高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素课前预习ppt课件,共28页。PPT课件主要包含了沉淀的生成,1原则,3方法,同离子效应法,思考与交流,沉淀的溶解,1原理,2举例,+H+,迅速溶解等内容,欢迎下载使用。
2021学年实验活动1 探究影响化学平衡移动的因素图文课件ppt: 这是一份2021学年实验活动1 探究影响化学平衡移动的因素图文课件ppt,共12页。PPT课件主要包含了②溶度积规则,①离子积等内容,欢迎下载使用。













