




- 专题05 pH值的计算- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题12 沉淀的溶解平衡 (1)- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题14 沉淀的溶解平衡 (3)- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题15 沉淀的溶解平衡 (4)- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题01 电离平衡 (电解质的分类) - 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
2021学年实验活动1 探究影响化学平衡移动的因素图文课件ppt
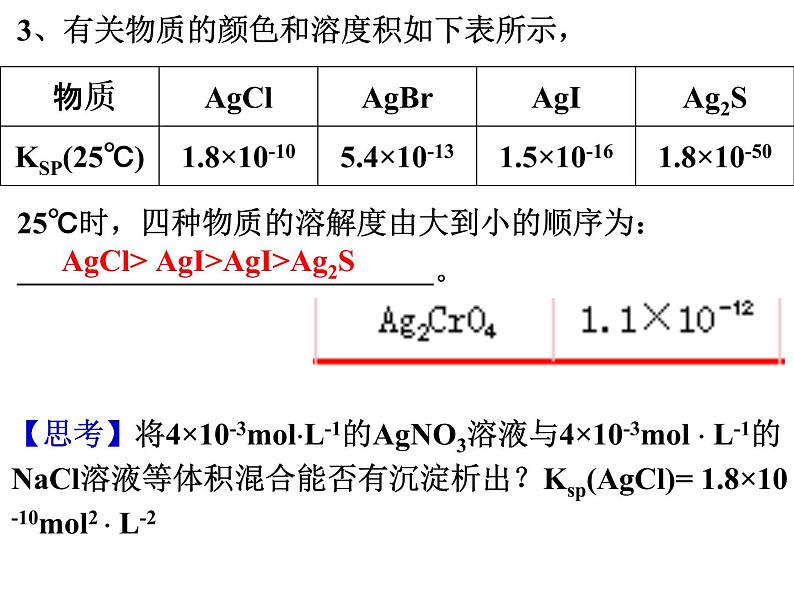
展开3、有关物质的颜色和溶度积如下表所示,25℃时,四种物质的溶解度由大到小的顺序为: 。
AgCl> AgI>AgI>Ag2S
【思考】将4×10-3mlL-1的AgNO3溶液与4×10-3ml L-1的NaCl溶液等体积混合能否有沉淀析出?Ksp(AgCl)= 1.8×10-10ml2 L-2
AnBm(s) ⇌nAm+(aq) + mBn-(aq)
Qc>Ksp时 Qc=Ksp时 Qc
Qc= c(Am+)n · c(Bn-)m
溶液过饱和,有沉淀析出,直至达到平衡。沉淀与饱和溶液的平衡。溶液不饱和,若体系中有沉淀,则沉淀会溶解直至达到平衡。
例2:将4×10-3mlL-1的AgNO3溶液与4×10-3mlL-1的NaCl溶液等体积混合能否有沉淀析出?Ksp(AgCl)= 1.8×10-10ml2L-2
解:混合后,c(Ag+)=2×10-3mlL-1 c(Cl-)=2×10-3mlL-1 Qc=C(Ag+) C(Cl-) =2 ×10-3mlL-1 × 2 ×10-3mlL-1 =4.0×10-6ml2L-2 >1.8×10-10ml2L-2 Qc>Ksp,所以有AgCl沉淀析出。
【变式】将4×10-3ml L-1的Pb(NO3)2溶液与2×10-3ml L-1的KI溶液等体积混合能否有沉淀析出?(已知:Ksp(PbI2)= 7.1×10-9ml3 L-3)
解:Qc=c(Pb2+)c(I-)2 =2 ×10-3mlL-1×(1×10-3mlL-1)2 =2×10-9 < Ksp(PbI2) 所以没有PbI2沉淀析出。
类型1、判断能否生成沉淀
例3、 在1L含1.0×10-3ml L-1 的SO42-溶液中,注入0.01ml BaCl2溶液(假设溶液体积不变)能否有效除去SO42-?已知:Ksp(BaSO4)= 1.1×10-10 ml2L-2
解:c(Ba2+)=0.01ml/L,c(SO42-)=0.001ml/L, 生成BaSO4沉淀后, Ba2+过量, 剩余的 c(Ba2+)= 0.01-0.001=0.009ml/L. c(SO42-)=Ksp/c(Ba2+)= 1.1×10-10/9.0×10-3 =1.2×10-8(ml/L)因为,剩余的即c(SO42-)=1.2×10-8ml/L<1.0×10-5ml/L所以, SO42-已沉淀完全,即有效除去了SO42-。
注意:当剩余离子即平衡离子浓度≤10-5ml/L时,认为离子已沉淀完全或离子已有效除去。
类型2、判断是否沉淀完全
例4.计算298K时使0.010ml·L-1Fe3+开始沉淀和沉淀完全时溶液的pH值。 (已知Fe(OH)3的Ksp=4.0×10-39)
类型3、金属氢氧化物沉淀的生成和溶解计算示例
例 4、计算298K时使0.010ml·L-1Fe3+开始沉淀和沉淀完全时溶液的pH值。已知Fe(OH)3的Ksp=2.64×10-39。
解: Fe(OH)3 (s) Fe3+ (aq) + 3OH- (aq)
c(Fe3+)·c(OH-)3 =Ksp
pOH = 13﹣lg 6.42 = 12.19
∴ pH = 14-12.19=1.81
c(Fe3+) ≤ 10-5 ml·L-1
pH = 14﹣(12﹣lg6.42) =2.81
由此可见:①氢氧化物沉淀不一定在碱性环境; ②不同氢氧化物的Ksp值不同,沉淀的pH值也不同,因此可通过控制pH值分离金属离子。
【变式】如果溶液中Fe3+和Mg2+的浓度均为0.10 mlL-1, 使Fe3+沉淀而使Mg2+不沉淀的pH条件是什么? 已知Ksp[Fe(OH)3]=4.0×10-39,Ksp[(Mg(OH)2]=1.8×10-11
pOH = 11.1 , pH = 2.9
解: Fe(OH)3 Fe3+ + 3OH- Ksp = c(Fe3+)c(OH-)3 = 4.0 ×10-39 Fe3+ 沉淀完全时的c(OH-)为:
Mg2+开始沉淀的pH值为:
pOH= 4.9, pH =9.1
因此, 只要控制pH值在2.9~9.1之间即可使Fe3+沉淀而使Mg2+不沉淀。
1、为除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是 ( )A、NaOH B、Na2CO3 C、氨水 D、MgO
2、在25℃下,向浓度均为0.1 ml·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 _______ 沉淀(填化学式),生成该沉淀的离子方程式为 。已知25℃时Ksp[Mg(OH)2]=1.8×10-11, KsP[Cu(OH)2]=2.2×10-20。
Cu(OH)2 Cu2++2NH3·H2O=Cu(OH)2 ↓+2NH4+
人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素集体备课ppt课件: 这是一份人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素集体备课ppt课件,共16页。PPT课件主要包含了沉淀溶解平衡实验,沉淀溶解平衡图像,NaHCO3,46×10-6等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素课前预习ppt课件: 这是一份高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素课前预习ppt课件,共28页。PPT课件主要包含了沉淀的生成,1原则,3方法,同离子效应法,思考与交流,沉淀的溶解,1原理,2举例,+H+,迅速溶解等内容,欢迎下载使用。
人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素图片ppt课件: 这是一份人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素图片ppt课件,共21页。PPT课件主要包含了硫酸铜晶体的变化,溶解成离子,结合成沉淀,保持不变,溶解平衡的建立,沉淀溶解平衡,电离平衡,BaSO4s,不等于零,发生移动等内容,欢迎下载使用。













