



- 专题12 沉淀的溶解平衡 (1)- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题13 沉淀的溶解平衡 (2)- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题15 沉淀的溶解平衡 (4)- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题01 电离平衡 (电解质的分类) - 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 1 次下载
- 专题02 电离平衡 (弱电解质的电离平衡- 名校同步2022-2023学年高二化学疑难点突破实用课件(人教版2019选择性必修1) 课件 2 次下载
高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素课前预习ppt课件
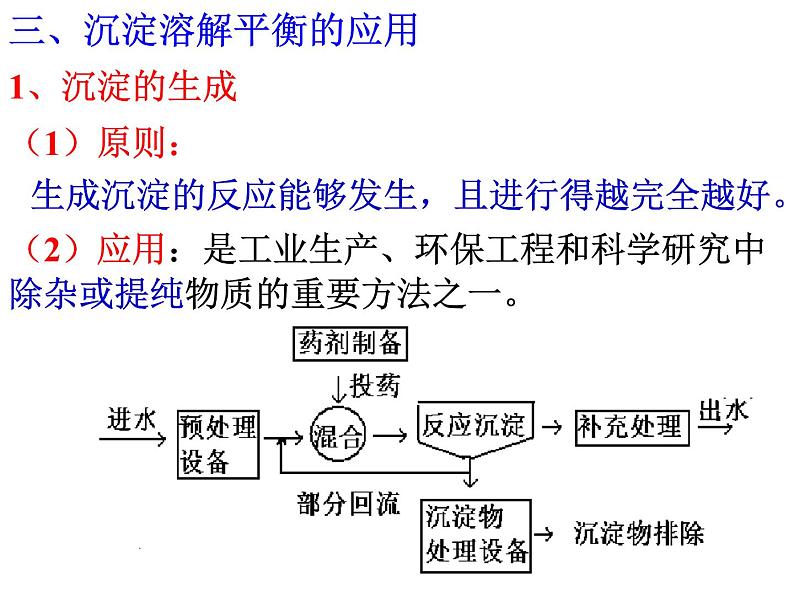
展开三、沉淀溶解平衡的应用
(2)应用:是工业生产、环保工程和科学研究中除杂或提纯物质的重要方法之一。
生成沉淀的反应能够发生,且进行得越完全越好。
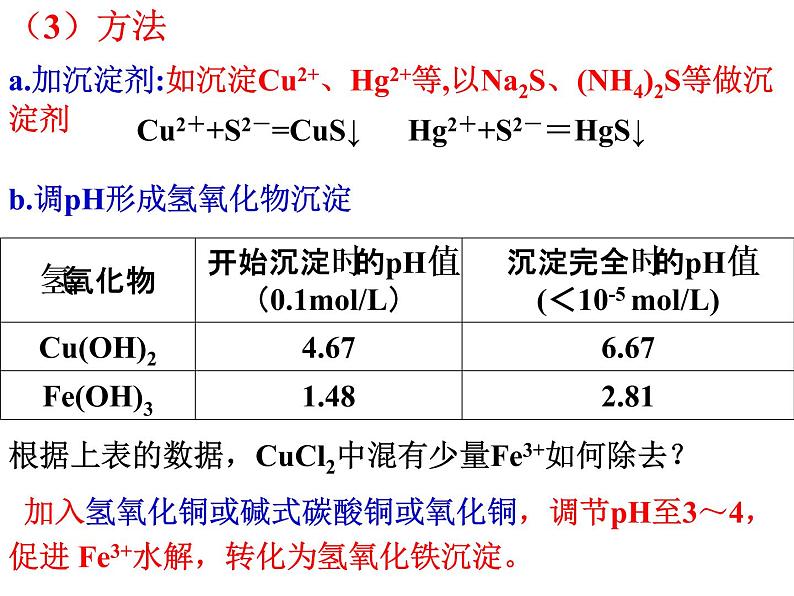
a.加沉淀剂:如沉淀Cu2+、Hg2+等,以Na2S、(NH4)2S等做沉淀剂
Cu2++S2-=CuS↓ Hg2++S2-=HgS↓
根据上表的数据,CuCl2中混有少量Fe3+如何除去?
b.调pH形成氢氧化物沉淀
加入氢氧化铜或碱式碳酸铜或氧化铜,调节pH至3~4,促进 Fe3+水解,转化为氢氧化铁沉淀。
向体系中加入硫酸,硫酸根浓度大,使平衡左移有利于沉淀生成。
硫酸钡在硫酸中的溶解度比在纯水中小
例1、将足量AgCl分别加入下列溶液中,AgCl溶解度由大到小的顺序是 ( ) ①20ml0.01ml/LKCl溶液 ②20ml0.02ml/LCaCl2溶液③20ml蒸馏水 ④20ml0.03ml/LHCl溶液⑤20ml0.05ml/L AgNO3溶液 A.①>②>④>③>⑤ B.③>①>④>②>⑤ C.⑤>③>②>①>④ D.③>④>⑤>②>①
通过氧化还原反应等方式改变某离子的存在形式,促使其转变为溶解度更小的难溶电解质以便分离出去。
在粗制CuSO4·5H2O晶体中常含有杂质Fe2+ 。在提纯时,为了除去Fe2+,常加入少量H2O2,使Fe2+氧化为Fe3+,然后再加少量碱到溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的。
1、如果要除去某溶液中的SO42-,你选择加入钡盐还是钙盐?为什么?
加入钡盐,因为BaSO4比CaSO4更难溶,使用钡盐可使SO42- 沉淀更完全。
2、以你现有的知识,你认为判断沉淀能否生成可从哪方面考虑?是否可能使要除去的离子通过沉淀反应全部除去?说明原因。
从溶解度方面可判断沉淀能否生成。不可能使要除去的离子通过沉淀完全除去。
当剩余离子即平衡离子浓度≤10-5ml/L时,可认为离子已沉淀完全或离子已有效除去。
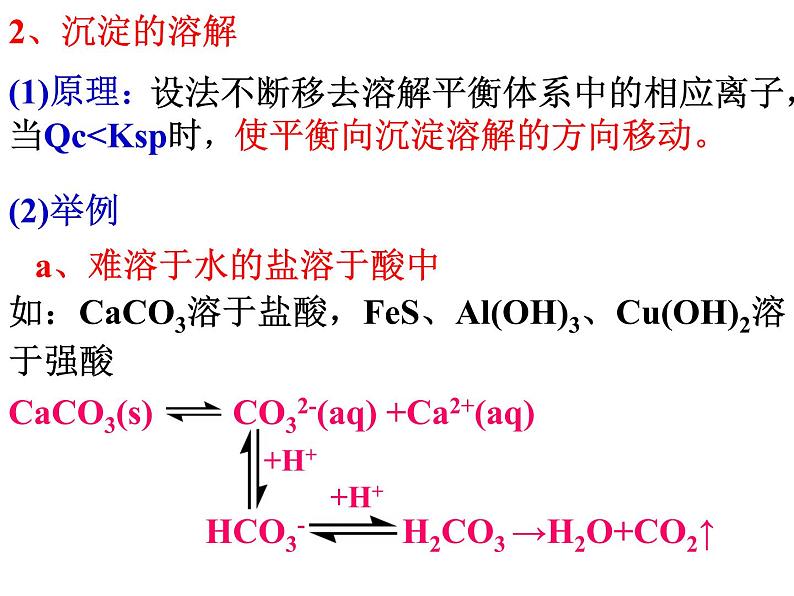
设法不断移去溶解平衡体系中的相应离子,当Qc
CaCO3(s) CO32-(aq) +Ca2+(aq)
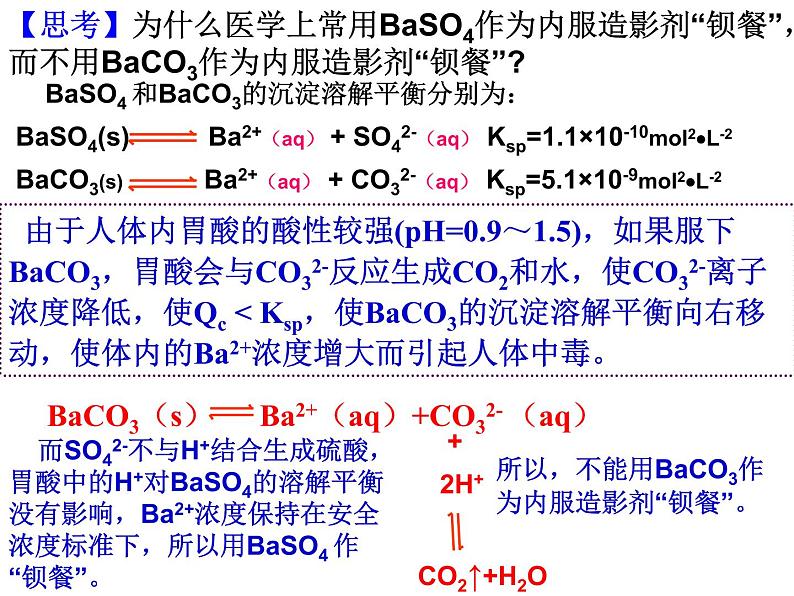
【思考】为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3作为内服造影剂“钡餐”?
由于人体内胃酸的酸性较强(pH=0.9~1.5),如果服下BaCO3,胃酸会与CO32-反应生成CO2和水,使CO32-离子浓度降低,使Qc < Ksp,使BaCO3的沉淀溶解平衡向右移动,使体内的Ba2+浓度增大而引起人体中毒。
所以,不能用BaCO3作为内服造影剂“钡餐”。
而SO42-不与H+结合生成硫酸,胃酸中的H+对BaSO4的溶解平衡没有影响,Ba2+浓度保持在安全浓度标准下,所以用BaSO4 作“钡餐”。
b 、难溶于水的电解质溶于某些盐溶液
【思考与交流】用平衡移动的原理分析Mg(OH)2溶于盐酸和NH4Cl溶液的原因。
固体无明显溶解现象,滴加酚酞,溶液显浅红色
【 实验3-3】向3支分别盛有少量Mg(OH)2固体的试管中,分别滴加适量的蒸馏水、稀盐酸、氯化铵溶液,预测观察现象并进行解释。
H+中和OH-,使c(OH-)减小,平衡右移,从而使Mg(OH)2溶解。
【解释】在溶液中存在Mg(OH)2的溶解平衡: Mg(OH)2(s) ⇌Mg2+(aq)+2OH-(aq)
NH4+与OH-结合,生成弱电解质NH3·H2O[它在水中比Mg(OH)2更难电离出OH-],使c(OH-)减小,平衡右移,从而使Mg(OH)2的沉淀溶解平衡向溶解方向移动。
(2)加入NH4Cl时:
(3)难溶电解质溶解的规律
不断减小溶解平衡体系中的相应离子,平衡就向沉淀溶解的方向移动,从而使沉淀溶解。
(4)几种促使沉淀溶解的基本方法: 温度的改变、溶液pH的调控、弱电解质的形成、配位化合物的形成或氧化还原反应等因素对难溶电解质溶解平衡的影响。
CaCO3(s) +2H+ = Ca2+ + H2O + CO2↑
FeS + 2H+ = Fe2+ + H2S
3CuS + 8HNO3(稀)=3Cu(NO3)2+ 3S↓+ 2NO↑+ 4H2O
AgCl + 2NH3 = [Ag(NH3)2]+ + Cl-
Fe(OH)3(s) + 3H+ = Fe3+ + 3H2O
Mg(OH)2(s) + 2NH4+ Mg2+ + 2NH3·H2O
练习1、试用平衡移动原理解释下列事实 (1)FeS不溶于水,但却能溶于稀盐酸中。 CaCO3难溶于稀硫酸,但却能溶于醋酸中。 (2)分别用等体积的蒸馏水和0.010ml/L硫酸洗涤BaSO4沉淀,用水洗涤造成的BaSO4的损失量大于用稀硫酸洗涤造成的损失量。
红褐色沉淀析出溶液褪至无色
(实验3-4、3-5 沉淀转化)
规律:一般来说,沉淀可以从溶解度小的向溶解度更小的方向转化,两者差别越大,转化越容易。
思考:如果将上述两个实验中沉淀生成和转化的操作步骤颠倒顺序,会产生什么结果?为什么?
沉淀不会转化。沉淀只是从溶解度小的向溶解度更小的方向转化。
使溶液中的离子浓度更小,使平衡向溶解的方向移动。
一般而言,溶解能力相对较强的物质易转化为溶解能力相对较弱的物质;溶解度相差越大,这种转化的趋势越大。
【思考】在ZnS沉淀加入10mL0.001ml/L的CuSO4溶液是否有CuS沉淀生成? 已知: Ksp(ZnS)=1.6×10-24 Ksp(CuS)=1.3×10-36
【高考常见题】下列实验中,对应的现象以及解释或结论都正确且具有因果关系的是 ( )
重金属离子(如Cu2+、Hg2+等)转化成沉淀
①在工业废水处理上的应用
加入Na2S、(NH4)2S等
【思考】锅炉水垢中除了CaCO3、Mg(OH) 2外,还含有难溶于水和酸的 CaSO4 ,如何清除?
可先用Na2CO3饱和溶液处理,使之转化为疏松、易溶于酸的CaCO3,再用酸处理。
CaSO4 (s)+CO32- (aq)= CaCO3(s)+ SO42-(aq)
练习2、牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡: Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43-(aq)+OH- (aq) 进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。
生成的有机酸能中和OH-,使平衡向脱矿方向移动,加速腐蚀牙齿腐蚀
已知Ca5(PO4)3F(固)的溶解度比上面的矿化产物更小,质地更坚固。 当牙膏中配有氟化物添加剂后能防止龋齿的原因是(用离子方程式表示): 。根据以上原理,请你提出一种其他促进矿化的方法: 。
5Ca2++3PO43-+ F- =Ca5(PO4)3F↓
加Ca2+(或加PO43-等)
③在工业生产和科研上的应用
先将难溶强酸盐转化为难溶弱酸盐,然后用酸溶解,使阳离子进入溶液。
BaSO4 、BaCO3
以重晶石(BaSO4)为原料制备可溶性钡盐的过程
Ksp(BaSO4 )=1.1×10-10, Ksp(BaCO3)=2.5×10-9.
溶解能力相近的难溶电解质,合适的条件下溶解能力相对较弱的物质也可以转化为溶解能力相对较强的物质。
④对一些自然现象的解释
CuSO4 + ZnS = CuS + ZnSO4
CuSO4 + PbS = CuS + PbSO4
【小结】: 沉淀的生成、溶解、转化本质上都是沉淀溶解平衡的移动问题,其基本依据主要有: ①浓度:加水,平衡向溶解方向移动。 ②温度:升温,多数平衡向溶解方向移动。 ③加入相同离子,平衡向沉淀方向移动。 ④加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子,使平衡向溶解的方向移动。
1、 将AgNO3溶液依次加入氯化钠溶液、溴化钠溶液、碘化钾溶液中都会出现不同颜色的沉淀,沉淀的颜色变化是 → → 。出现这种颜色变化的原因是: 。
沉淀可以从溶解度小的向溶解度更小的方向转化
2、下列说法正确的是 ( ) A.钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba2+转化为碳酸钡而排出 B.工业上用NaHS、(NH4)2S等可溶性硫化物作沉淀剂除去废水中的Hg2+、Cu2+等,但不能使用FeS等不溶性硫化物作沉淀剂 C.水中的碳酸氢镁、碳酸氢钙受热易分解生成难溶性的碳酸镁、碳酸钙,故水垢的主要成分是碳酸镁、碳酸钙 D.珊瑚虫从周围海水中获取Ca2+和HCO3—,经反应形成石灰石外壳,从而逐渐形成珊瑚
3、以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质是 ( ) A.具有吸附性 B.溶解度与CuS、PbS、CdS等相同 C.溶解度大于CuS、PbS、CdS D.溶解度小于CuS、PbS、CdS
4、已知BaCO3和BaSO4均为难溶电解质,其溶度积分别为Ksp(BaCO3) =5.1×10-9ml2•L-2,Ksp(BaSO4) =1.1×10-10 ml2•L-2,则下列说法中正确的是 ( ) A.BaSO4可做钡餐而BaCO3不能,是因为Ksp(BaSO4) <Ksp(BaCO3) B.在制腈纶纤维的1 L溶液中含SO42-为1.0×10-3ml,则加入0.01 ml BaCl2不能使SO42-完全沉淀 C.在清理有关仪器的BaSO4沉淀时,常加入饱和Na2CO3溶液,使BaSO4转化为BaCO3再用酸处理 D.用稀H2SO4洗涤BaSO4效果比用水好,BaCO3也能用此法处理
人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素集体备课ppt课件: 这是一份人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素集体备课ppt课件,共16页。PPT课件主要包含了沉淀溶解平衡实验,沉淀溶解平衡图像,NaHCO3,46×10-6等内容,欢迎下载使用。
2021学年实验活动1 探究影响化学平衡移动的因素图文课件ppt: 这是一份2021学年实验活动1 探究影响化学平衡移动的因素图文课件ppt,共12页。PPT课件主要包含了②溶度积规则,①离子积等内容,欢迎下载使用。
人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素图片ppt课件: 这是一份人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素图片ppt课件,共21页。PPT课件主要包含了硫酸铜晶体的变化,溶解成离子,结合成沉淀,保持不变,溶解平衡的建立,沉淀溶解平衡,电离平衡,BaSO4s,不等于零,发生移动等内容,欢迎下载使用。













