
统考版高考化学一轮复习课时作业19原电池化学电源含答案
展开这是一份统考版高考化学一轮复习课时作业19原电池化学电源含答案,共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
1.在超市里经常会看到一种外壳为纸层包装的电池,印有如图所示的文字。下列有关说法错误的是( )
A.该电池是一次电池
B.该电池工作时,电子由负极通过外电路流入正极
C.该电池含有的金属元素中毒性最大的是Hg
D.该电池工作时,外电路中每通过0.2 ml电子,锌的质量理论上减少3.25 g
2.控制适合的条件,将反应2Fe3++2I-⇌2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
3.普通锌锰干电池的简图如图所示。该电池工作时的总反应为Zn+2NH eq \\al(\s\up11(+),\s\d4(4)) +2MnO2===[Zn(NH3)2]2++Mn2O3+H2O。下列关于锌锰干电池的说法中正确的是( )
A.当该电池电压逐渐下降后,利用电解原理能重新充电复原
B.电池负极反应式为2MnO2+2NH eq \\al(\s\up11(+),\s\d4(4)) +2e-===Mn2O3+2NH3+H2O
C.原电池工作时,电子从负极通过外电路流向正极
D.外电路中每通过0.1 ml电子,锌的质量理论上减小6.5 g
4.电化学在日常生活中用途广泛,下图是镁—次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O===Cl-+Mg(OH)2↓,下列说法不正确的是( )
A.惰性电极上发生氧化反应
B.镁电极是该电池的负极
C.正极反应式为ClO-+H2O+2e-===Cl-+2OH-
D.进料口加入NaClO溶液,出口为NaCl溶液
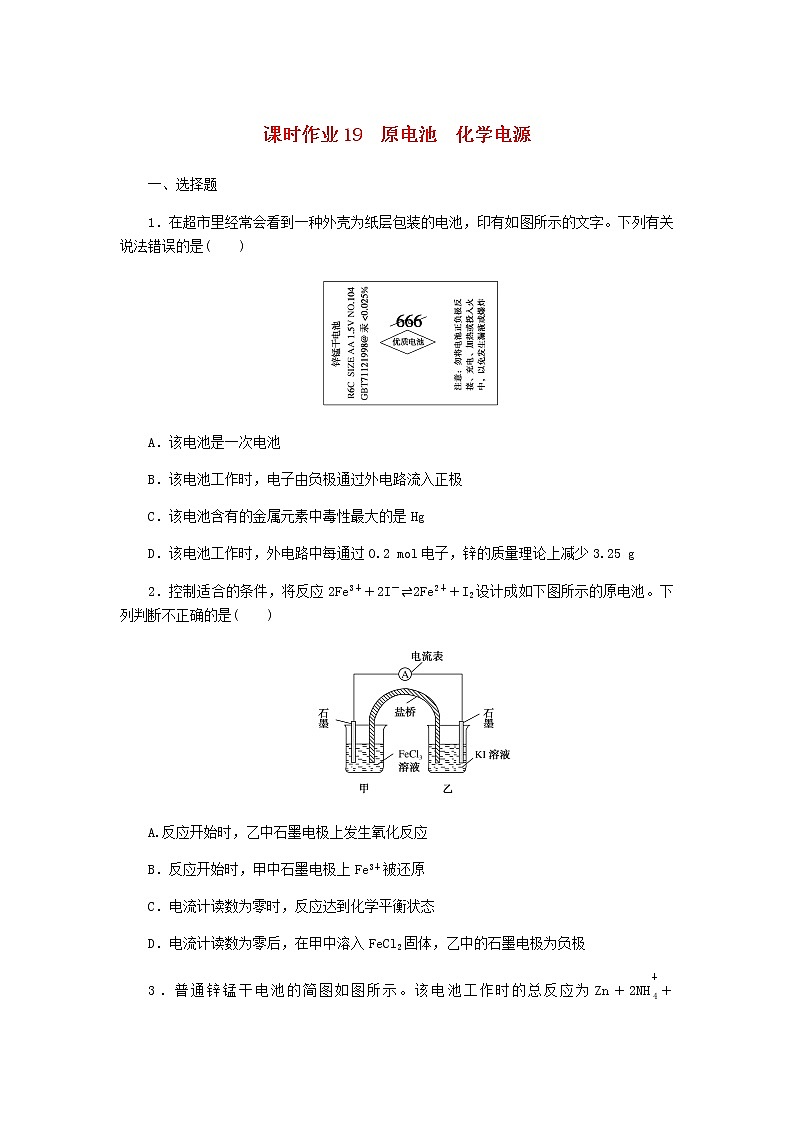
5.液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是( )
A.b电极发生氧化反应
B.a电极的电极反应式为
N2H4+4OH--4e-===N2↑+4H2O
C.放电时,电流从a电极经过负载流向b电极
D.其中的离子交换膜需选用阳离子交换膜
6.利用碳纳米管能够吸附氢气,设计一种新型二次电池,其装置如图所示。关于该电池的叙述不正确的是( )
A.电池放电时K+移向正极
B.电池放电时负极反应为:
H2-2e-+2OH-===2H2O
C.电池充电时镍电极上NiOOH转化为Ni(OH)2
D.电池充电时碳纳米管电极与电源的负极相连
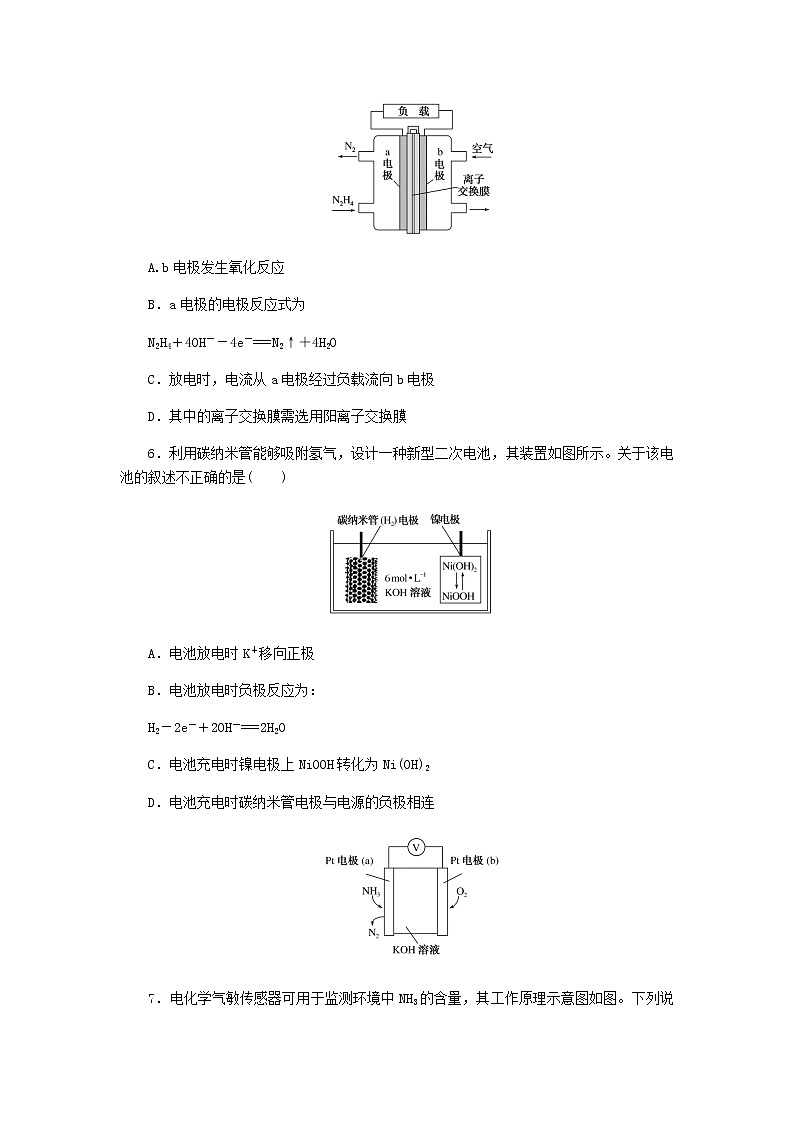
7.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。下列说法不正确的是( )
A.O2在电极b上发生还原反应
B.溶液中OH-向电极a移动
C.反应消耗的NH3与O2的物质的量之比为4∶5
D.负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O
8.已知:锂离子电池的总反应为:LixC+Li1-xCO2 eq \(,\s\up11(放电),\s\d4(充电)) C+LiCO2;锂硫电池的总反应为:2Li+S eq \(,\s\up11(放电),\s\d4(充电)) Li2S。
有关上述两种电池说法正确的是( )
A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.如图表示用锂离子电池给锂硫电池充电
9.如图为利用电化学方法处理有机废水的原理示意图。下列说法正确的是( )
A.a、b极不能使用同种电极材料
B.工作时,a极的电势低于b极的电势
C.工作一段时间之后,a极区溶液的pH增大
D.b极的电极反应式为:CH3COO-+4H2O-8e-===2HCO eq \\al(\s\up11(-),\s\d4(3)) +9H+
10.某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池结构如图所示。电池总反应为:MnO2+ eq \f(1,2) Zn+ (1+ eq \f(x,6) )H2O+ eq \f(1,6) ZnSO4 eq \(,\s\up11(放电),\s\d4(充电)) MnOOH+ eq \f(1,6) ZnSO4[Zn(OH)2]3·xH2O
下列说法中,正确的是( )
A.充电时,Zn2+移向Zn膜
B.充电时,含有MnO2膜的碳纳米管纤维一端连接有机高聚物电源负极
C.放电时,电子由锌膜表面经有机高聚物至MnO2膜表面
D.放电时,电池的负极反应为:
MnO2+e-+H2O===MnOOH+OH-
11.2016年评出的十大创新技术之一是碳呼吸电池,电池原理如图所示,则下列有关说法正确的是( )
A.该装置将电能转变为化学能
B.正极的电极反应为
C2O eq \\al(\s\up11(2-),\s\d4(4)) -2e-===2CO2
C.每生成1 ml Al2(C2O4)3,有6 ml电子流过负载
D.随着反应进行,草酸盐浓度不断变小
12.金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度。它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如图,下列说法正确的是( )
A.放电时,空气极为负极
B.放电时,电池反应为4Li+O2===2Li2O
C.有机电解液可以是乙醇等无水有机物
D.在更换锂电极的同时,要更换水性电解液
13.一种微生物燃料电池如图所示,下列关于该电池说法正确的是( )
A.a电极发生还原反应
B.H+由右室通过质子交换膜进入左室
C.b电极上的电极反应式为
2NO eq \\al(\s\up11(-),\s\d4(3)) +10e-+12H+===N2↑+6H2O
D.电池工作时,电流由a电极沿导线流向b电极
二、非选择题
14.(1)锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:
①外电路的电流方向是由________极流向________极(填字母)。
②电池正极反应式为_____________________________________________________。
③是否可用水代替电池中的混合有机溶剂?______(填“是”或“否”),原因是________________________________________________________________________
________________________________________________________________________。
(2)氨氧燃料电池具有很大的发展潜力。氨氧燃料电池工作原理如图所示。
①a电极的电极反应式是_____________________________________________。
②一段时间后,需向装置中补充KOH,请依据反应原理解释原因是________________________________________________________________________
________________________________________________________________________。
课时作业19 原电池 化学电源
1.解析:电池工作时,锌失去电子,电极反应式为Zn-2e-===Zn2+所以外电路中每通过0.2 ml电子,锌的质量理论上应减少6.5 g,所以D项错误。
答案:D
2.解析:由图示结合原电池原理分析可知,Fe3+得电子变成Fe2+被还原,I-失去电子变成I2被氧化,所以A、B正确;电流计读数为零时Fe3+得电子速率等于Fe2+失电子速率,反应达到平衡状态,C正确;D项在甲中溶入FeCl2固体,平衡2Fe3++2I-⇌2Fe2++I2向左移动,I2被还原为I-,乙中石墨为正极,D不正确。
答案:D
3.解析:普通锌锰干电池是一次电池,不能充电复原,A项错误;根据原电池工作原理,负极失电子,B项错误;由负极的电极反应式可知,每通过0.1 ml电子,消耗锌的质量是65 g·ml-1× eq \f(0.1 ml,2) =3.25 g,D项错误。
答案:C
4.解析:由总反应可知镁发生氧化反应,“负氧正还原”,镁为负极,惰性电极上发生还原反应,A项错误,B项正确;负极反应为:Mg-2e-+2OH-===Mg(OH)2↓,正极反应为:ClO-+2e-+H2O===Cl-+2OH-,C、D项正确。
答案:A
5.解析:燃料电池燃料(N2H4)在负极(a电极)发生氧化反应:N2H4+4OH--4e-===N2↑+4H2O,O2在正极发生还原反应:O2+4e-+2H2O===4OH-,总反应为N2H4+O2===N2+2H2O,A项错误,B项正确;放电时电流由正极流向负极,C项错误;OH-在正极生成,移向负极,所以离子交换膜应让OH-通过,故选用阴离子交换膜,D项错误。
答案:B
6.解析:原电池放电时,阳离子向正极移动,A项正确;该电池中H2在负极上失电子,发生氧化反应,因电解质溶液为碱性溶液,故OH-参与反应,B项正确;放电时,正极(镍电极)上发生化合价降低的还原反应,即由NiOOH转化为Ni(OH)2,充电时正好相反,由Ni(OH)2转化为NiOOH,C项错误;充电时,该新型二次电池在外加电流的作用下,碳纳米管电极上发生还原反应,故碳钠米管电极作阴极,与电源负极相连,D项正确。
答案:C
7.解析:构成的原电池中,通入氧气的电极是正极,发生还原反应,A正确;溶液中阴离子氢氧根离子移向负极a极,B正确;1 ml NH3反应生成氮气转移 3 ml电子,1 ml O2反应转移4 ml电子,根据电子守恒,消耗的NH3与O2的物质的量之比为4∶3,C错误;负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O,D正确。
答案:C
8.解析:锂离子电池放电时Li+(阳离子)向正极迁移,A项错误;锂硫电池放电时负极反应为锂失去电子变为锂离子,发生氧化反应,则充电时,锂电极发生还原反应,B项正确;比能量是指参与电极反应的单位质量的电极材料放出电能的大小,二者的比能量不同,C项错误;充电时原电池的负极与电解池的阴极相连,故应为C与Li相连,D项错误。
答案:B
9.解析:根据图示:工作时,b极上CH3COO-→HCO eq \\al(\s\up11(-),\s\d4(3)) ,碳原子从0价升至+4价,b极是原电池的负极,则a极是电池的正极。a、b极上发生的反应为电解质溶液的变化,电极材料可同可异,A项错误;a极(正极)的电势高于b极(负极)的电势,B项错误;a极(正极)电极反应式为,正极每得到2 ml电子时,为使溶液保持电中性,必须有2 ml H+通过质子交换膜进入a极溶液,同时电极反应消耗1 ml H+,故工作一段时间之后,a极区溶液中H+浓度增大,pH减小,C项错误;据图中物质转化,考虑到质量守恒和电荷守恒关系,b极(负极)反应为CH3COO-+4H2O-8e-===2HCO eq \\al(\s\up11(-),\s\d4(3)) +9H+,D项正确。
答案:D
10.解析:充电时,阳离子移向阴极,此时含有锌膜的碳纳米管纤维一端作为阴极,因此Zn2+应移向Zn膜,选项A正确;充电时,MnOOH在MnO2膜表面失电子生成MnO2,因此含有MnO2膜的碳纳米管纤维一端作为阳极连接电源正极,选项B错误;电子从锌膜失去后通过外电路到MnO2膜表面,不会进入电解质溶液中,选项C错误;电池的负极反应是锌失去电子的反应,电极反应为Zn-2e-+2OH-===Zn(OH)2,选项D错误。
答案:A
11.解析:A项,该装置属于原电池,将化学能转化为电能,错误;B项,原电池正极上发生得电子的还原反应,结合电池原理图可得正极反应式为:2CO2+2e-===C2O eq \\al(\s\up11(2-),\s\d4(4)) ,错误;C项,每生成1 ml Al2(C2O4)3,负极有2 ml Al失去电子,共失去6 ml电子,所以有6 ml电子流过负载,正确;D项,根据正负极反应情况可得电池总反应为2Al+6CO2===Al2(C2O4)3,所以反应过程中不消耗草酸盐,错误。
答案:C
12.解析:A.放电时,Li极为负极,错误;B.放电时,电池反应为4Li+O2+2H2O=== 4LiOH,错误;C.因为有锂存在,就不能用乙醇,锂和乙醇反应,错误;D.水性电解液中有沉淀生成,所以在更换锂电极的同时,要更换水性电解液,正确,所以选D。
答案:D
13.解析:在a电极苯酚生成CO2,被氧化,A项错误;阳离子向正极移动,即H+向b电极移动,B项错误;b电极为正极,NO eq \\al(\s\up11(-),\s\d4(3)) 得到电子生成N2,电极反应式为2NO eq \\al(\s\up11(-),\s\d4(3)) +10e-+12H+===N2↑+6H2O,C项正确;a电极是负极,b电极是正极,电池工作时,电流由b电极沿导线流向a电极,D项错误。
答案:C
14.解析:(1)①结合所给装置图以及原电池反应原理,可知Li作负极材料,MnO2作正极材料,所以电子流向是从a→b,那么电流方向则是b→a。②根据题目中的信息“电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2”,所以正极的电极反应式为MnO2+e-+Li+===LiMnO2。③因为负极的电极材料Li是活泼的金属,能够与水发生反应,故不能用水代替电池中的混合有机溶剂。(2)a电极是通入NH3的电极,失去电子,发生氧化反应,所以该电极作负极,电极反应式是2NH3-6e-+6OH-===N2+6H2O;一段时间后,需向装置中补充KOH,是由于发生4NH3+3O2===2N2+6H2O反应,有水生成,使得溶液逐渐变稀,为了维持碱的浓度不变,所以要补充KOH。
答案:(1)①b a
②MnO2+e-+Li+===LiMnO2
③否 电极材料Li是活泼金属,能与水反应
(2)①2NH3-6e-+6OH-===N2+6H2O
②由于发生4NH3+3O2===2N2+6H2O反应,有水生成,使得溶液逐渐变稀,所以要补充KOH
相关试卷
这是一份2024届高考化学一轮复习课时分层作业30原电池化学电源含答案,文件包含2024届高考化学一轮复习课时分层作业30原电池化学电源含答案docx、2024届高考化学一轮复习课时分层作业30参考答案docx等2份试卷配套教学资源,其中试卷共8页, 欢迎下载使用。
这是一份2024届高考化学一轮复习 课时分层作业32 原电池 化学电源 (含答案),共10页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习课时练18原电池化学电源含答案