






- 3.1《铁及其化合物 》课件+教案 课件 45 次下载
- 3.2《金属材料 》课件+教案 课件 42 次下载
- 4.1《原子结构》课件+教案 课件 40 次下载
- 4.2《原子结构与元素的性质》课件+教案 课件 39 次下载
- 4.4《化学键》课件+教案 课件 41 次下载
人教版 (2019)必修 第一册第二节 元素周期律获奖ppt课件
展开人教版化学科高一年必修一
《元素周期律》教学设计
课题 | 元素周期律 | 课型 | 新授课 |
教学目标 | 1理解元素周期律的实质。 | ||
2掌握元素周期律内容—原子半径、金属性和非金属性、化合价。 | |||
3了解元素周期表和元素周期律的应用 | |||
教学重难点 | 重点:元素周期律的实质与内容 | ||
难点:元素周期律的实质与内容 | |||
教学环节 | 教学过程 | ||
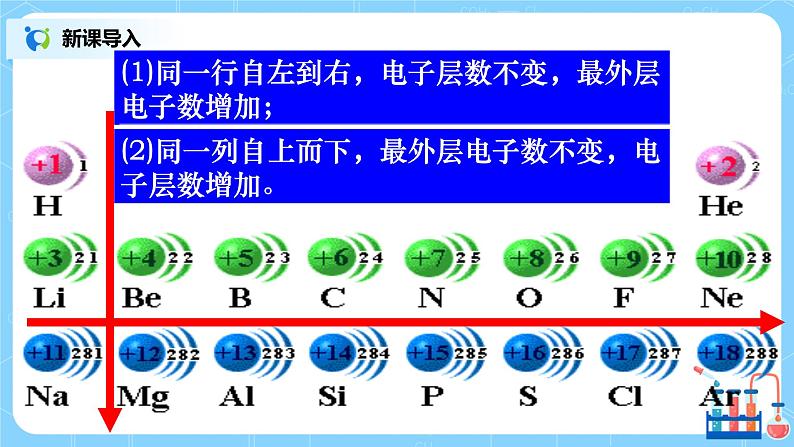
课堂导入 | 【新课导入】下图为1~18号元素的原子结构示意图,观察半径随原子序数的递增有什么规律性的变化? 提示:(1)同一行自左到右,电子层数不变,最外层电子数增加; (2)同一列自上而下,最外层电子数不变,电子层数增加。 | ||
课程 学习
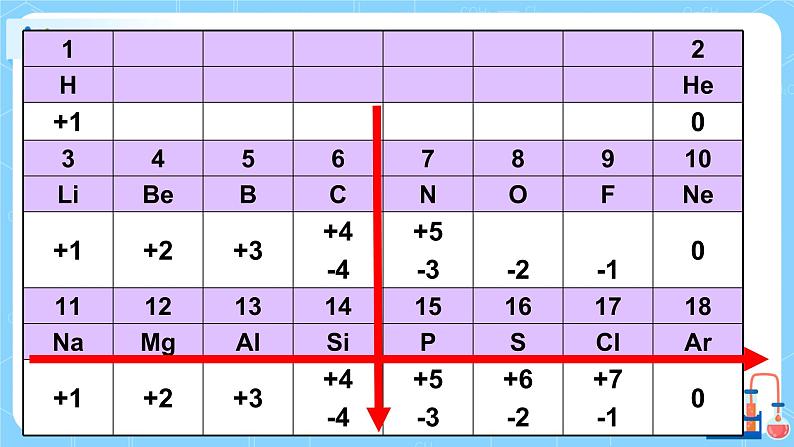
| 一、原子半径 1. 元素周期律:元素的性质随着原子序数的递增而呈周期性的变化 影响因素:层数多,半径大;核电荷数大,半径小 同周期主族元素:从左至右原子半径递减 同主族元素:从上至下原子半径递增 电子层结构相同的离子原子序数小的半径大! 【巩固提升】 1、按原子半径由小到大的顺序排列: C、O、F、Na、Si、K、Rb 2、已知aXm+、bYn+、cZm-、dRn- (m<n)四种离子的电子层结构相同,则它们的原子半径、离子半径由大到小的顺序排列为: 2. 化合价 主族元素族序数=最高正价=价电子数 非金属最低负化合价=主族元素族序数-8 同周期的主族元素从左至右 化合价由+1→+7, -4 →0递增 3.金属性与非金属性 金属性:金属单质的还原性 非金属性:非金属单质的氧化性 结论:同周期从左到右金属性减弱;同主族从上到下金属性增强 拓展:①金属性越强金属单质的还原性越强(越易失电子),对应阳离子的氧化性越弱;②金属性越强 金属的最高价氧化物对应水化物碱性越强 非金属性越强最高价氧化物对应水化物的酸性越强 二、元素周期表和元素周期律的应用 1.元素在周期表中的位置、性质和原子结构的关系 结构决定性质,性质决定用途,位置反映结构。 2. 寻找新材料 金属和非金属的分界线附近寻找半导体材料(如锗、硅、硒) 在过渡元素(副族和Ⅷ族元素)中寻找各种优良的催化剂(铂、镍、钒等)和耐高温、耐腐蚀材料(如制造火箭和飞机的钛钼) 在非金属区寻找合成农药的元素(如S、P、Cl、N) 三、课堂练习 1.运用元素周期律分析,下列说法错误的是( ) A.Ra是第7周期ⅡA族的元素,Ra(OH)2的碱性比Mg(OH)2的碱性强 B.As是第4周期ⅤA族的元素,AsH3的还原性比NH3的还原性弱 C.Cs的原子半径比Na的原子半径大,Cs与水反应比Na与水反应更剧烈 D.Cl的核电荷数比Al的核电荷数大,Cl的原子半径比Al的原子半径小 2.元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( ) A.同一元素不可能既表现金属性,又表现非金属性 B.第3周期元素的最高正化合价等于它所处的主族序数 C.短周期元素形成离子后,最外层都达到8电子稳定结构 D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同 3.下列实验不能达到实验目的的是 | ||
课堂 小结 | 一、元素周期律 二、元素周期表和元素周期律的应用 | ||
板书设计 | 一、元素周期律 核外电子排布呈周期性变化 原子半径呈周期性变化 元素主要化合价呈周期性变化 元素金属性、非金属性呈周期性变化 二、元素周期表和元素周期律的应用 | ||
教学反思 | 学生在学习本节课之前已经学习了元素周期表,所以本节课从对元素周期表的深层次认识为切入点,通过 精讲、活动、反思、自悟、探究、讨论”等课堂教学活动引导学生认识到元素结构和性质上的变化规律及同一周期元素结构和性质变化的特点,促使学生发现与理解元素原子结构、性质的变化周期与元素周期表中的周期建立起有机的联系。 | ||
高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质课文课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质课文课件ppt,共26页。PPT课件主要包含了HNO3,NaOH,d64s2,第四周期第Ⅷ族,N⋮⋮N,HClO4,NH3,SiH4,O>N>C>K,C>H>Si等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质说课ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质说课ppt课件,共60页。PPT课件主要包含了第2课时元素周期律等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律公开课ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律公开课ppt课件,共60页。PPT课件主要包含了元素周期律,法国的古名为,“家里亚”,核外电子排布,原子半径,主要化合价,金属性和非金属性,元素性质,金属性与非金属性,Na>Mg>Al等内容,欢迎下载使用。














