







- 3.1《铁及其化合物 》课件+教案 课件 47 次下载
- 3.2《金属材料 》课件+教案 课件 44 次下载
- 4.1《原子结构》课件+教案 课件 40 次下载
- 4.2《原子结构与元素的性质》课件+教案 课件 39 次下载
- 4.3《元素周期律》课件+教案 课件 40 次下载
人教版 (2019)必修 第一册第四章 物质结构 元素周期律第三节 化学键一等奖ppt课件
展开人教版化学科高一年必修一
《化学键》教学设计
课题 | 化学键 | 课型 | 新授课 |
教学目标 | 1理解离子键的概念,能用电子式表示离子化合物的形成过程。 | ||
2理解共价键的概念,能用电子式表示共价化合物的形成过程。 | |||
3认识事物变化过程中量变引起质变的规律性 | |||
教学重难点 | 重点:离子键、共价键的概念 | ||
难点:离子键、共价键的概念 | |||
教学环节 | 教学过程 | ||
课堂导入 | 【新课导入】构成物质的微粒有原子、离子、分子等,不同物质含有不同的微粒,这些微粒间必须通过一定的相互作用力才能彼此结合。那么,微粒间的相互作用力有哪些呢?作用力的大小又对物质性质有什么影响? 通常,我们把物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。 化学键分为离子键、共价键、金属键等不同的类型。 | ||
课程 学习
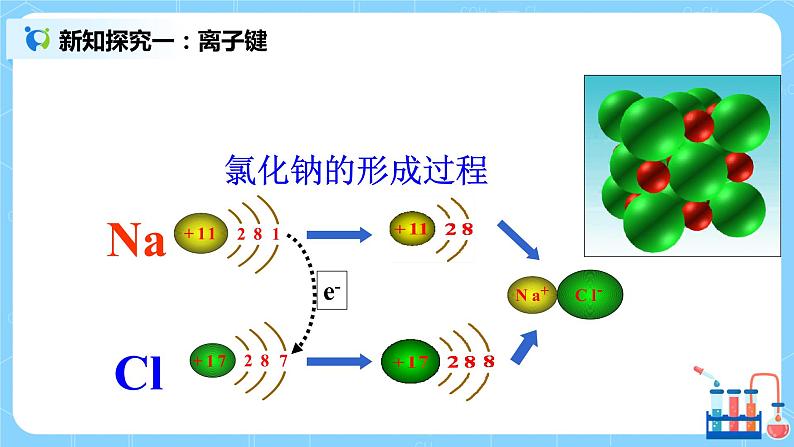
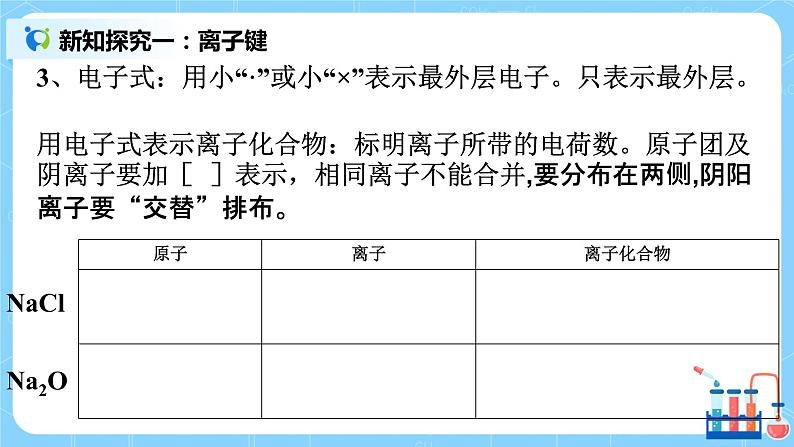
| 一、离子键 1. 使带相反电荷的阴、阳离子结合的相互作用(强烈的静电作用)称为叫做离子键。 常见的离子键存在: ①活泼金属(第ⅠA族、第ⅡA族)的金属与活泼非金属(第ⅥA族、第Ⅶ A族的金属)。例如MgO。 ②大部分的盐类,离子键存在于盐的金属阳离子和酸根离子之间,例如Na2SO4晶体中,Na+与SO42-之间就是通过离子键结合的 ③强碱的金属阳离子与OH-之间的相互作用也是离子键 下列物质中存在离子键的是 , ①SiO2 ②Na2O2 ③H2SO4 ④Na2O ⑤NH4Cl ⑥MgCl2 ⑦Cl2 ⑧NaOH ⑨CH4 2、离子化合物:物质中只要存在离子键,这类化合物都是离子化合物 离子化合物在熔融后,离子键被破坏,阴阳离子不再被“固定”而是可以自由移动,所以离子化合物熔融后都能导电。由于离子键是“强烈的”,破坏离子键需要较多的能量,所以离子化合物的熔沸点都较高。 离子化合物溶于水后,离子键也被破坏,所以它们的水溶液也能导电。 3、电子式:用小“·”或小“×”表示最外层电子。只表示最外层。 用电子式表示离子化合物:标明离子所带的电荷数。原子团及阴离子要加[ ]表示,相同离子不能合并,要分布在两侧,阴阳离子要“交替”排布。 练习:写出下列电子式 S F- CaCl2 2. 二、共价键:直接相邻的两个原子间通过共用电子对所形成的的化学键。 成键微粒:直接相邻的两个原子 成键本质:共用电子对 1、存在:从物质种类来看:非金属单质、非金属氧化物、酸、原子团内部、少部分盐、少部分碱是由共价键形成的 下列物质中存在共价键的是 ,既含离子键又含共价键的是 . ①SiO2 ②Na2O2 ③H2SO4 ④Na2O ⑤NH4Cl ⑥MgCl2 ⑦Cl2 ⑧NaOH ⑨CH4 2、共价化合物:只含有共价键的化合物 上述中属于共价化合物的有 3、共价键的电子式表示方法:共用电子对写在两个原子之间,不加[ ];若是带电的原子团,写完共用电子对后,整个原子团加并[ ]在右上角标上所带的电荷数。 三、从粒子间的相互作用认识物质及其变化 化学键的形成,与原子结构有关,它主要通过原子的价电子间的转移或者共用来实现。 从表面上看,化学反应式反应物中的原子重新组合为产物分子的一种过程。其实,在化学反应中,包含着反应物分子内化学键的断裂和产物分子中化学键的形成。 研究证实:化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程 四、课堂练习 1.下列说法中,正确的是 A. 相邻的原子之间的相互作用叫做化学键 B. 金属和非金属元素的相互化合,都能形成离子键 C. 非金属元素的原子半径比其离子半径小(氢除外),金属元素的原子的原子半径比其离子半径大 D. 阴、阳离子间通过静电引力而形成的化学键叫做离子键 2.下列物质属于共价化合物的是( ) A.NH4Cl B.HNO3 C. H2 D.Na2O2 3. 下列性质中,可以用来证明某化合物一定是离子化合物的是 ( ) A.熔融状态能导电 B.水溶液能导电 C.可溶于水 D.具有较高的熔点 | ||
课堂 小结 | 一、离子键 二、共价键 三、从粒子间的相互作用认识物质及其变化 | ||
板书设计 | 一、离子键 1存在 2离子化合物 3电子式书写 二、共价键 1存在 2离子化合物 3电子式书写 三、从粒子间的相互作用认识物质及其变化 | ||
教学反思 | 化学键的学习将学生对物质结构的认识推上了一个新的台阶。通过初中化学的学习,学生已经知道原子可结合成分子、原子失去或得到电子后可以变成离子、离子可结合成物质、但不知道原子是怎样结合成分子的,离子是怎样结合成物质的;已知道化学反应过程中会发生物质的变化,但不知道变化的实质。已知燃烧是化学变化,物质燃烧要释放能量,但不知道化学反应中为什么会伴随能量变化。化学键概念的建立为学生从原子、分子水平认识物质的构成和化学反应打开了一扇窗,是认识化学反应实质的基础。 | ||
高中化学人教版 (2019)必修 第一册第三节 化学键获奖ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第三节 化学键获奖ppt课件,共60页。PPT课件主要包含了第三节化学键,研习一离子键,自读教材,要点归纳,题组训练,研习二电子式,研习三共价键等内容,欢迎下载使用。
人教版 (2019)第三节 化学键教课课件ppt: 这是一份人教版 (2019)第三节 化学键教课课件ppt,文件包含43《化学键》第二课时课件pptx、43《化学键》第二课时教案docx、43《化学键》第二课时练习docx等3份课件配套教学资源,其中PPT共20页, 欢迎下载使用。
高中化学第三节 化学键集体备课ppt课件: 这是一份高中化学第三节 化学键集体备课ppt课件,文件包含43《化学键》第一课时课件pptx、43《化学键》第一课时教案docx、43《化学键》第一课时练习docx等3份课件配套教学资源,其中PPT共21页, 欢迎下载使用。














