



高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率说课课件ppt
展开1.了解活化能的含义,学会用有效碰撞理论解释化学反应速率的影响因素。2.掌握外界条件(浓度、压强)对化学反应速率的影响规律。
从微观上分析,化学反应速率与哪些因素有关?
碰撞理论要点反应物分子间必须相互碰撞才有可能发生反应,反应速率的大小与单位时间内反应物分子碰撞次数成正比。
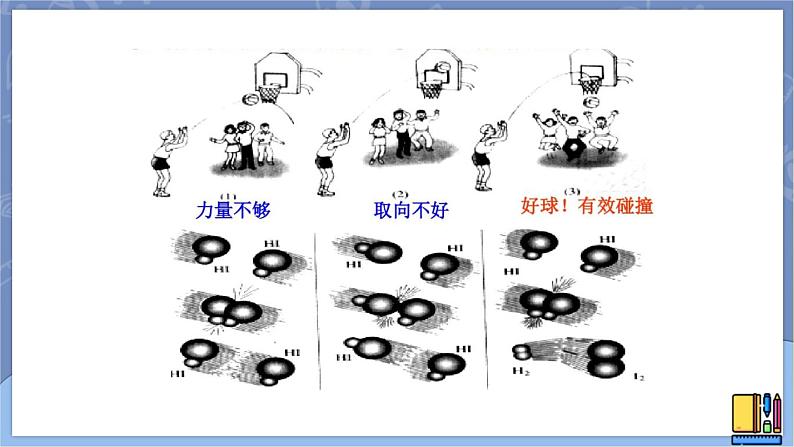
发生有效碰撞的条件:①分子必须具有足够高的能量;②分子在一定的方向上发生碰撞。
有效碰撞的定义:能发生反应的碰撞。
活化分子:能量较高,有可能发生有效碰撞的分子。活化能:活化分子的平均能量与所有分子的平均能量之差称为活化能。
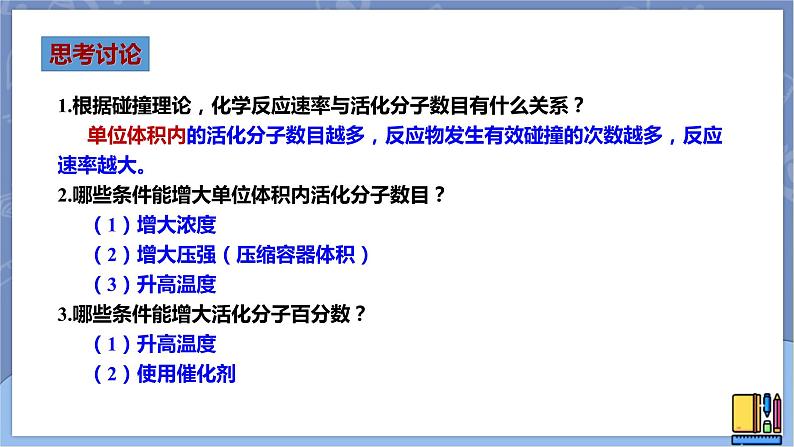
1.根据碰撞理论,化学反应速率与活化分子数目有什么关系? 单位体积内的活化分子数目越多,反应物发生有效碰撞的次数越多,反应速率越大。2.哪些条件能增大单位体积内活化分子数目? (1)增大浓度 (2)增大压强(压缩容器体积) (3)升高温度3.哪些条件能增大活化分子百分数? (1)升高温度 (2)使用催化剂
基元反应:反应物分子经过一次碰撞就转化为产物分子的反应,称为基元反应,反应过程中没有任何中间物生成。
基元反应的活化能与反应速率的关系每个基元反应都有对应的活化能,活化能越大,活化分子所占比例越小,有效碰撞的比例就越小,化学反应速率越小。
复杂反应:经过两个或多个步骤完成的反应。
浓度对反应速率的影响 其他条件相同时,增大反应物的浓度,反应速率增大;减小反应物的浓度,反应速率减小。
Na2S2O3溶液与稀硫酸反应
实验现象:_______________________________________实验结论:_______________________________________
(1)对于可逆反应,若增大生成物的浓度,正反应速率和逆反应速率如何变化? 增大生成物的浓度,反应向逆反应方向进行,反应物的浓度也增大,因此正反应速率和逆反应速率都增大。(2)如何用碰撞理论解释浓度对反应速率的影响? 增大反应物的浓度,单位体积内活化分子数目增大,有效碰撞次数增多,反应速率增大。(3)浓度对反应速率的影响适用范围是什么? 适用于在溶液中进行的反应或气体反应。固体和纯液体的浓度为常数,对反应速率无影响。
1.在化学反应中,若反应物分别以气体、液体或固体三种状态存在,改变反应体系的压强,反应物的浓度是否发生变化呢?
改变压强,对固体、液体之间或溶液中进行的反应,影响很小。
2.增大体系的压强,气体的浓度如何变化?
对于有气体参加的反应,保持温度不变时,增大压强,容器的体积减小,相当于增大了反应物和生成物的浓度。
对有气体参加的反应,在密闭容器中保持温度不变时,增大压强,气体体积减小,相当于增大反应物的浓度,反应速率增大;减小压强,气体体积增大,相当于减小反应物的浓度,反应速率减小。
压强对反应速率的影响,可以归结为浓度改变对反应速率的影响。
由于固体、液体粒子间的空隙很小,改变压强几乎不能改变它们的浓度,因此对只有固体或液体参加的反应,压强的变化对于反应速率的影响可以忽略不计。
已知反应 在一定条件下的密闭容器中反应并达到化学平衡。(1)若容器体积一定,向容器中再充入一定量的N2,反应速率如何变化? 反应物浓度增大,反应速率增大。(2)若容器体积一定,向容器中再充入一定量的氦气,反应速率如何变化? 反应物的浓度没有改变,对反应速率无影响。(3)若保持压强不变,向容器中再向容器中充入一定量的氦气,反应速率如何变化? 充入氦气后容器体积增大,反应物浓度减小,反应速率减小。
影响反应速率的因素1.主要因素影响化学反应速率的主要因素是反应物的性质。例如:金属钠与冷水剧烈反应,而镁和沸水仅能微弱反应。2.外部因素影响反应速率的外部因素有:浓度、温度、压强、催化剂及反应物之间的接触面积、光、电磁波、超声波等。
1.决定化学反应速率的内因是( )①温度 ②压强 ③催化剂 ④浓度 ⑤反应物本身的性质A.①②③④⑤ B.⑤C.①④ D.①②③④
2.对于反应C(s)+H2O(g) CO(g)+H2(g),其他条件不变时,下列措施不能改变化学反应速率的是( )A.增大C(s)的量 B.增大H2O(g)的浓度C.增大CO(g)或H2(g)的浓度 D.减小H2O(g)的浓度
答案:A解析:改变浓度,可以改变化学反应速率,而改变固体物质的物质的量不能改变化学反应速率,因为固体物质的浓度可视为常数。
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率课文课件ppt: 这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率课文课件ppt,共18页。
人教版 (2019)选择性必修1第一节 化学反应速率精品课件ppt: 这是一份人教版 (2019)选择性必修1第一节 化学反应速率精品课件ppt,共50页。PPT课件主要包含了知识梳理,正误判断,问题导学,核心突破,试题调研,完成课时作业六,课后作业等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度课前预习ppt课件: 这是一份苏教版 (2019)选择性必修1第二单元 化学反应的方向与限度课前预习ppt课件,共13页。PPT课件主要包含了学习目标,复习回顾,常见的可逆反应有,交流讨论,可逆反应有哪些特征,化学平衡状态的特征,课堂练习等内容,欢迎下载使用。













