



苏教版 (2019)选择性必修1第一单元 化学反应速率教学演示ppt课件
展开1.掌握外界条件(温度、催化剂)对化学反应速率的影响规律。2.能用过渡态理论解释催化剂对反应速率的影响。3.了解其他条件对化学反应速率的影响。
酸性高锰酸钾溶液与草酸反应
现象预测:____________________________________实验现象:____________________________________实验结论:____________________________________
其他条件相同时,升高温度,反应速率增大;降低温度,反应速率减小。许多反应的温度每升高10K,反应速率增加2~4倍。
升高温度,原来的一部分分子转化为活化分子,活化分子百分数增加,单位体积内活化分子数目增加,有效碰撞次数增加,反应速率增大。
温度对反应速率的影响,对放热反应和吸热反应都适用,且不受反应物状态的限制。
实验现象:_______________________________________________。
催化剂对反应速率有显著的影响。
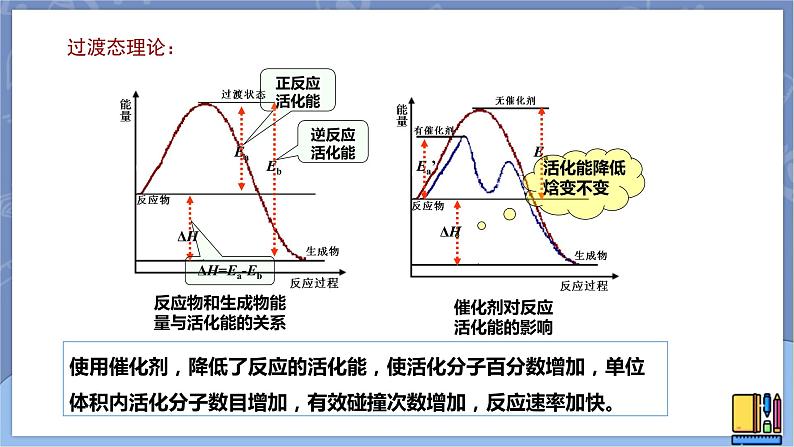
反应物和生成物能量与活化能的关系
催化剂对反应活化能的影响
使用催化剂,降低了反应的活化能,使活化分子百分数增加,单位体积内活化分子数目增加,有效碰撞次数增加,反应速率加快。
催化剂对反应速率的影响催化剂是通过降低化学反应所需的活化能来增大化学反应速率的。有催化剂参与的反应,活化能(Ea1)较小,反应速率较大;没有催化剂参与的反应,活化能(Ea1')较大,反应速率较小。使用催化剂同时降低了正反应和逆反应的活化能,但反应的ΔH不变。
基元反应模型(1)反应历程:一个化学反应自开始后所经历的过程称为反应历程。(2)基元反应的逆反应也是基元反应,并且经过同一个过渡状态。(3)复杂反应中的速率控制步骤决定了该反应的速率。
2NO+O2===2NO2的反应模型:①2NO===N2O2(快)②N2O2===2NO(快)③N2O2+O2===2NO2(慢)
慢反应③是决定整个反应速率的关键步骤。
(1)酶是一种特殊的、具有催化活性的生物催化剂。(2)酶的催化原理:
酶的催化作用是酶与反应物先形成中间化合物,然后中间化合物分解成产物并释放酶。
(3)酶的催化特点:①高效的催化活性;②高度的选择性;③特殊的温度效应。
其他因素对化学反应速率的影响(1)增大反应物之间的接触面积,反应速率增大。硫酸工业中,硫铁矿在焚烧前先用粉碎机粉碎,以增大矿石与氧气的接触面积,加快燃烧;三氧化硫吸收阶段,吸收塔填装瓷环,增大气液接触面积。(2)光、电磁波、超声波等因素,也会对化学反应速率产生影响。
条件改变对反应速率的影响
1.实验室要增大铁与盐酸反应的速率,可以采取的措施有_______________________、__________________________________(写出2种措施)。
答案:①改用铁粉;②增大盐酸的浓度;③适当升高温度。
2.已知分解1mlH2O2放出98kJ的热,在含少量I-的溶液中,H2O2的分解机理为:H2O2+I-→H2O+IO-(慢),H2O2+IO-→H2O+O2+I-(快)。下列有关该反应的说法正确的是( )A.反应速率与I-的浓度有关B.IO-也是该反应的催化剂C.反应活化能等于98kJ·ml-1D.v(H2O2)=v(H2O)=v(O2)
答案:A解析:A选项,H2O2+I-→H2O+IO-是慢反应,是过氧化氢分解的决速步骤,I-是反应物之一,其浓度大小对反应有影响正确;B选项,将两个基元反应相加可得总反应方程式,反应的催化剂是I-,IO-只是中间产物,错误;C选项,1ml过氧化氢分解的△H=-98KJ·ml-1,△H不是反应的活化能,是生成物与反应物的能量差,错误;D选项,因为反应是在含少量I-的溶液中进行的,溶液中水的浓度是常数,不能用其浓度变化表示反应速率,错误。故选A。
人教版 (2019)选择性必修1第一节 化学反应速率精品课件ppt: 这是一份人教版 (2019)选择性必修1第一节 化学反应速率精品课件ppt,共50页。PPT课件主要包含了知识梳理,正误判断,问题导学,核心突破,试题调研,完成课时作业六,课后作业等内容,欢迎下载使用。
选择性必修1第一节 化学反应速率优质课ppt课件: 这是一份选择性必修1第一节 化学反应速率优质课ppt课件
选择性必修1第二单元 化学反应的方向与限度集体备课ppt课件: 这是一份选择性必修1第二单元 化学反应的方向与限度集体备课ppt课件,共13页。PPT课件主要包含了学习目标,交流讨论,课堂探究,ADE,ABDE,ABDF,ABC,ABE,ABCDE等内容,欢迎下载使用。













