






还剩10页未读,
继续阅读
所属成套资源:高中化学新苏教版选修一课件PPT全册
成套系列资料,整套一键下载
苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第四单元 沉淀溶解平衡教课内容ppt课件
展开
这是一份苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第四单元 沉淀溶解平衡教课内容ppt课件,共18页。PPT课件主要包含了学习目标,复习回顾,①②③,④⑤⑥,⑦⑧⑨,固体溶质,溶液中的溶质,实验探究,交流讨论,课堂探究等内容,欢迎下载使用。
1.掌握沉淀溶解平衡的概念及沉淀溶解平衡的影响因素。2.理解溶度积常数的概念,能用溶度积规则判断沉淀的产生、溶解。
20 ℃时,溶解性与溶解度的关系
下列物质,属于易溶物质的是___________,属于微溶物质的是________,属于难溶物质的是____________。①NaCl、②NaOH、③H2SO4、④MgCO3、⑤CaSO4、⑥Ca(OH)2、⑦CaCO3、⑧BaSO4、⑨Mg(OH)2
固体物质的溶解是可逆过程:
难溶物质是指溶解度小于0.01g的物质。
固体溶质在水中的溶解是有限度的,当溶液在一定温度下达到饱和状态时,固体溶质的量不再减少,溶液中溶质微粒的浓度不再发生变化。
将少量PbI2固体加入盛有一定量水的烧杯中,用玻璃棒充分搅拌,静置。取2mL上层清液中于试管中,滴加AgNO3溶液。实验现象:实验结论:
试管中有黄色沉淀生成。
PbI2的溶解度很小,但仍有极少量的溶解。
在有AgCl沉淀生成的溶液中,同时存在溶解过程和沉淀过程。
在一定温度下,当沉淀溶解和生成的速率相等时,体系中形成了饱和溶液,即建立了动态平衡,叫做沉淀溶解平衡。
沉淀溶解平衡状态有哪些特征?
(1)动态平衡:v溶解=v沉淀≠0。(2)达到平衡时,溶液中离子的浓度保持不变。(3)当改变外界条件时,溶解平衡将发生移动,达到新的平衡。
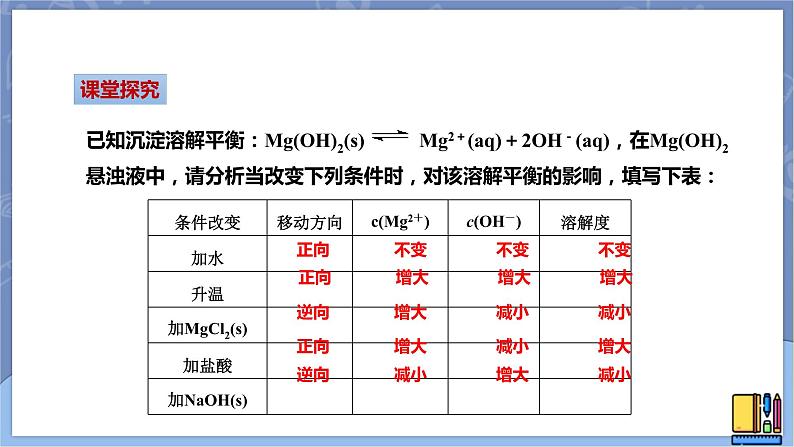
已知沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),在Mg(OH)2悬浊液中,请分析当改变下列条件时,对该溶解平衡的影响,填写下表:
正向 不变 不变 不变
正向 增大 增大 增大
逆向 增大 减小 减小
正向 增大 减小 增大
逆向 减小 增大 减小
影响沉淀溶解平衡的因素
难溶物质溶解程度的大小,主要取决于物质本身的性质。
影响沉淀溶解平衡的外部因素:(1)温度:温度升高,多数溶解平衡向溶解的方向移动。(2)浓度:加水稀释,浓度减小,平衡向溶解方向移动。(3)同离子效应:加入与难溶电解质构成微粒相同的物质,平衡向生成沉淀的方向移动。(4)化学反应:加入与难溶电解质溶解所得的离子反应的物质,平衡向溶解的方向移动。
当水中溶有的CO2浓度较大时,平衡向着碳酸钙溶解的方向移动;当CO2浓度减小或温度较高时,平衡向着逆反应方向移动。
在一定温度下,难溶电解质达到沉淀溶解平衡后的溶液为饱和溶液,其离子浓度不再发生变化,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积),用Ksp表示。
溶度积(Ksp)反映了物质在水中的溶解能力。对同类型的难溶电解质(如AgCl、AgBr、AgI)而言,Ksp越小,难溶电解质在水中的溶解能力越小。
溶度积常数Ksp的意义
已知碳酸钙难溶于水1.CaCO3在水中的溶解平衡可表示为___________________________。2 .CaCO3的溶度积常数表达式为______________________________。3 .常温下,将少量碳酸钙加入一定量的水中,充分搅拌后仍有固体存在。此时溶解过程是否停止?请说明理由。4 .将CaCO3分别加入水和饱和碳酸钠溶液中,达到沉淀溶解平衡,请比较两个体系中Ca2+浓度的大小。5 .请设计实验方案,使的沉淀溶解平衡向碳酸钙溶解的方向移动。
Ksp(CaCO3)=c(Ca2+)·c(CO32-)
没有停止,碳酸钙的沉淀溶解平衡是一个可逆过程,沉淀溶解的速率与生成沉淀的速率相等。
在水中的浓度大于在饱和碳酸钠溶液中的浓度
将少量碳酸钙加入一定量的水中,充分搅拌,仍有固体存在,再加入几滴盐酸,可以观察到沉淀减少。
通过比较溶度积Ksp与溶液中有关离子浓度幂的乘积Qc的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解:
(1)Qc>Ksp,生成沉淀。(2)Qc=Ksp,沉淀溶解平衡。(3)Qc将10mL0.02ml·L-1CaCl2溶液与等体积、等浓度的Na2C2O4溶液混合,已知CaC2O4的Ksp=2.34×10-9。试根据溶度积判断是否有CaC2O4沉淀生成。
溶液混合后,c(Ca2+)=0.01ml·L-1, c(C2O42-)=0.01ml·L-1Qc= c(Ca2+)· c(C2O42-)=1.0×10-4>Ksp(CaC2O4)因此有CaC2O4沉淀生成。
1.下列对“难溶”的理解正确的是( )A.在水中难溶的物质,在其他溶剂中也是难溶的B.难溶就是绝对不溶C.难溶就是溶解度相对较小,没有绝对不溶于水的电解质D.如果向某溶液中加入足量另一种试剂时,生成了难溶性的电解质,则说明原溶液中的相应离子已沉淀完全
答案:C解析:难溶是指物质在水中的溶解度小于0.01 g。
2.下列有关AgCl沉淀的溶解平衡状态的说法中,正确的是( )A.AgCl沉淀的生成和溶解不断进行,但速率相等B.AgCl难溶于水,溶液中没有Ag+和Cl-C.升高温度,AgCl的溶解度不变 D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变
答案:A解析:AgCl固体在溶液中存在溶解平衡,所以溶液中有Ag+和Cl-,B错;升高温度,AgCl溶解度增大,C错;向平衡体系中加入NaCl固体,增大了c(Cl-),溶解平衡左移,AgCl溶解度减小,D错。
1.掌握沉淀溶解平衡的概念及沉淀溶解平衡的影响因素。2.理解溶度积常数的概念,能用溶度积规则判断沉淀的产生、溶解。
20 ℃时,溶解性与溶解度的关系
下列物质,属于易溶物质的是___________,属于微溶物质的是________,属于难溶物质的是____________。①NaCl、②NaOH、③H2SO4、④MgCO3、⑤CaSO4、⑥Ca(OH)2、⑦CaCO3、⑧BaSO4、⑨Mg(OH)2
固体物质的溶解是可逆过程:
难溶物质是指溶解度小于0.01g的物质。
固体溶质在水中的溶解是有限度的,当溶液在一定温度下达到饱和状态时,固体溶质的量不再减少,溶液中溶质微粒的浓度不再发生变化。
将少量PbI2固体加入盛有一定量水的烧杯中,用玻璃棒充分搅拌,静置。取2mL上层清液中于试管中,滴加AgNO3溶液。实验现象:实验结论:
试管中有黄色沉淀生成。
PbI2的溶解度很小,但仍有极少量的溶解。
在有AgCl沉淀生成的溶液中,同时存在溶解过程和沉淀过程。
在一定温度下,当沉淀溶解和生成的速率相等时,体系中形成了饱和溶液,即建立了动态平衡,叫做沉淀溶解平衡。
沉淀溶解平衡状态有哪些特征?
(1)动态平衡:v溶解=v沉淀≠0。(2)达到平衡时,溶液中离子的浓度保持不变。(3)当改变外界条件时,溶解平衡将发生移动,达到新的平衡。
已知沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),在Mg(OH)2悬浊液中,请分析当改变下列条件时,对该溶解平衡的影响,填写下表:
正向 不变 不变 不变
正向 增大 增大 增大
逆向 增大 减小 减小
正向 增大 减小 增大
逆向 减小 增大 减小
影响沉淀溶解平衡的因素
难溶物质溶解程度的大小,主要取决于物质本身的性质。
影响沉淀溶解平衡的外部因素:(1)温度:温度升高,多数溶解平衡向溶解的方向移动。(2)浓度:加水稀释,浓度减小,平衡向溶解方向移动。(3)同离子效应:加入与难溶电解质构成微粒相同的物质,平衡向生成沉淀的方向移动。(4)化学反应:加入与难溶电解质溶解所得的离子反应的物质,平衡向溶解的方向移动。
当水中溶有的CO2浓度较大时,平衡向着碳酸钙溶解的方向移动;当CO2浓度减小或温度较高时,平衡向着逆反应方向移动。
在一定温度下,难溶电解质达到沉淀溶解平衡后的溶液为饱和溶液,其离子浓度不再发生变化,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积),用Ksp表示。
溶度积(Ksp)反映了物质在水中的溶解能力。对同类型的难溶电解质(如AgCl、AgBr、AgI)而言,Ksp越小,难溶电解质在水中的溶解能力越小。
溶度积常数Ksp的意义
已知碳酸钙难溶于水1.CaCO3在水中的溶解平衡可表示为___________________________。2 .CaCO3的溶度积常数表达式为______________________________。3 .常温下,将少量碳酸钙加入一定量的水中,充分搅拌后仍有固体存在。此时溶解过程是否停止?请说明理由。4 .将CaCO3分别加入水和饱和碳酸钠溶液中,达到沉淀溶解平衡,请比较两个体系中Ca2+浓度的大小。5 .请设计实验方案,使的沉淀溶解平衡向碳酸钙溶解的方向移动。
Ksp(CaCO3)=c(Ca2+)·c(CO32-)
没有停止,碳酸钙的沉淀溶解平衡是一个可逆过程,沉淀溶解的速率与生成沉淀的速率相等。
在水中的浓度大于在饱和碳酸钠溶液中的浓度
将少量碳酸钙加入一定量的水中,充分搅拌,仍有固体存在,再加入几滴盐酸,可以观察到沉淀减少。
通过比较溶度积Ksp与溶液中有关离子浓度幂的乘积Qc的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解:
(1)Qc>Ksp,生成沉淀。(2)Qc=Ksp,沉淀溶解平衡。(3)Qc
溶液混合后,c(Ca2+)=0.01ml·L-1, c(C2O42-)=0.01ml·L-1Qc= c(Ca2+)· c(C2O42-)=1.0×10-4>Ksp(CaC2O4)因此有CaC2O4沉淀生成。
1.下列对“难溶”的理解正确的是( )A.在水中难溶的物质,在其他溶剂中也是难溶的B.难溶就是绝对不溶C.难溶就是溶解度相对较小,没有绝对不溶于水的电解质D.如果向某溶液中加入足量另一种试剂时,生成了难溶性的电解质,则说明原溶液中的相应离子已沉淀完全
答案:C解析:难溶是指物质在水中的溶解度小于0.01 g。
2.下列有关AgCl沉淀的溶解平衡状态的说法中,正确的是( )A.AgCl沉淀的生成和溶解不断进行,但速率相等B.AgCl难溶于水,溶液中没有Ag+和Cl-C.升高温度,AgCl的溶解度不变 D.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度不变
答案:A解析:AgCl固体在溶液中存在溶解平衡,所以溶液中有Ag+和Cl-,B错;升高温度,AgCl溶解度增大,C错;向平衡体系中加入NaCl固体,增大了c(Cl-),溶解平衡左移,AgCl溶解度减小,D错。













