





高中化学苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡说课课件ppt
展开1.了解水的电离平衡和水的离子积常数。2.掌握影响水的电离平衡的因素。3.知道水的离子积常数的应用。
水是一种极弱的电解质,水的电离过程如下:
水的电离方程式:H2O+H2O H3O++OH-
简写为:H2O H++OH-
1.请写出水的电离平衡常数表达式。
2.计算在纯水中,c(H2O)=_____________。
在一定温度下,纯水和稀溶液中,c(H2O)可视为定值。
水的离子积常数:Kw=K·c(H2O)=c(H+)·c(OH-)
水的离子积常数不仅适用于纯水,也适用于稀的电解时水溶液。
已知:H2O H++OH- ΔH=57kJ·ml-1,不同温度下,水的离子积如下表:
解释不同温度下,KW值出现差异的原因。
水的电离过程是中和反应的逆过程,是吸热的,升高温度,水的电离平衡向电离的方向移动。
影响水的电离平衡的外界因素有哪些?
水的电离平衡受酸碱度、温度、其他盐的性质的影响。(1)酸碱度:c(H+)或c(OH-)增大,抑制水的电离。(2)温度:温度升高,促进水的电离。(3)盐效应:加入某些盐,盐电离出的弱碱离子(如NH4+)或弱酸根离子(如CH3COO-)能促进水的电离。
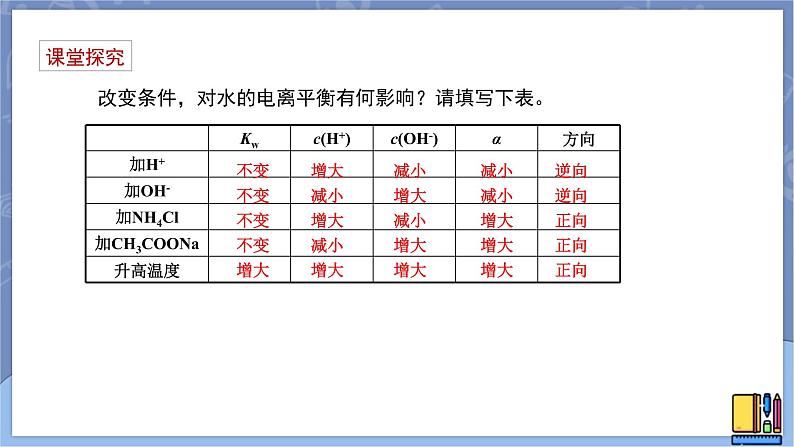
改变条件,对水的电离平衡有何影响?请填写下表。
不变 增大 减小 减小 逆向不变 减小 增大 减小 逆向不变 增大 减小 增大 正向不变 减小 增大 增大 正向增大 增大 增大 增大 正向
某温度下纯水中c(H+)=2×10-7 ml·L-1,则此时c(OH-)=________________;该温度下向纯水中加盐酸使c(H+)=5×10-6 ml·L-1,则此时c(OH-)=__________________。
2×10-7 ml·L-1
8×10-9 ml·L-1
25℃时,在纯水中,水电离出的c(H+)与c(OH-)均为1.0×10-7ml·L-1。 (1)升高温度,水电离出的c(H+)与c(OH-)将如何变化? (2)在0.1 ml·L-1的盐酸溶液中,c(H+)=________ml·L-1,c(OH-)=__________ml·L-1。水电离出的c(H+)=_________ ml·L-1,水电离出的c(OH-)=__________ ml·L-1。(2)在0.1 ml·L-1的NaOH溶液中,c(OH-)=______ml·L-1,c(H+)=_________ml·L-1。水电离出的c(H+)=_________ ml·L-1,水电离出的c(OH-)=__________ ml·L-1。
c(H+)与c(OH-)都增大
1. 任何溶液中,由水电离出的c(H+)和c(OH-)总是相等的。2.注意区分溶液中的c(H+)、由水电离出的c(H+)。(前者指溶液中总的氢离子浓度,后者特指由水电离出来的氢离子浓度)。3.室温下, c(H+)=1.0×10-13ml·L-1,该溶液可能是酸性(如0.1ml·L-1的盐酸),也可能是碱性(如0.1ml·L-1的NaOH溶液)。
1.下列关于水的离子积常数的叙述中,正确的是( )A.Kw随溶液中c(H+)和c(OH-)的变化而变化B.水的离子积常数Kw与水的电离平衡常数K是同一个物理量C.水的离子积常数仅仅是温度的函数,随着温度的变化而变化D.水的离子积常数Kw与水的电离平衡常数K是两个没有任何关系的物理量
答案:C解析:水的离子积常数Kw=K·c(H2O)。一定温度下K和c(H2O)都是不变的常数,所以Kw仅仅是温度的函数。水的离子积常数的表达式是Kw=c(H+)·c(OH-),但是只要温度一定,Kw就是不变的常数。溶液中H+的浓度变大,OH-的浓度就变小,反之亦然。
2.25 ℃时,水的电离达到平衡:H2O H++OH- ΔH>0,下列叙述正确的是( )A.向水中加入稀氨水,平衡逆向移动,c(OH-)减小B.向水中加入少量固体CH3COONa,c(H+)增大,Kw不变C.向水中加入少量固体硫酸氢钠,平衡逆向移动,c(H+)减小D.将水加热,Kw增大,pH减小
答案:D解析:向水中加入稀氨水,c(OH-)增大,平衡逆向移动,c(H+)减小,A项不正确;向水中加入少量CH3COONa后,使水的电离平衡正向移动,c(H+)减小,Kw不变,B项不正确;向水中加入少量固体NaHSO4:NaHSO4===Na++H++SO42-,c(H+)增大,但Kw不变,C项正确;将水加热,水的电离平衡正向移动,c(H+)、c(OH-)均增大,Kw增大,pH减小,但仍呈中性,D项正确。故选D。
3.能影响水的电离平衡,并使溶液中的 c(H+)>c(OH-)的操作是( )A.向水中投入一小块金属钠B.将水加热煮沸C.向水中通入二氧化碳气体D.向水中加食盐晶体
答案:C解析:A选项,加入金属钠,钠与水电离出的H+反应,c(H+)减小,c(OH-)增大,错误;B选项,加热煮沸,水的电离平衡正向移动,但溶液仍呈中性,错误;C选项,通入二氧化碳,生成H2CO3,H2CO3 H++HCO3-,c(H+)减小,c(OH-)增大,平衡逆向移动,正确;D选项,加入食盐,对水的电离平衡五影响,错误。故选C。
高中化学苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡公开课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡公开课课件ppt,共60页。PPT课件主要包含了水的电离,Kw的应用,课时对点练等内容,欢迎下载使用。
高中化学第一单元 弱电解质的电离平衡图片ppt课件: 这是一份高中化学第一单元 弱电解质的电离平衡图片ppt课件,共60页。PPT课件主要包含了NO1,NO2,NO3,点击右图进入等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡教课ppt课件: 这是一份苏教版 (2019)选择性必修1第一单元 弱电解质的电离平衡教课ppt课件,共13页。PPT课件主要包含了学习目标,交流讨论,课堂练习,77×10-5,80×10-5,421%,34%,21×10-3,34×10-3,电离平衡常数的意义等内容,欢迎下载使用。













