




















2022_2023学年新教材高中化学第2章化学键化学反应规律第2节化学反应与能量转化第2课时化学反应能量转化的重要应用__化学电池课件鲁科版必修第二册20220801139
展开
这是一份2022_2023学年新教材高中化学第2章化学键化学反应规律第2节化学反应与能量转化第2课时化学反应能量转化的重要应用__化学电池课件鲁科版必修第二册20220801139,文件包含2022_2023学年新教材高中化学第2章化学键化学反应规律第2节化学反应与能量转化第1课时化学反应中能量变化的本质及转化形式课件鲁科版必修第二册20220801138pptx、2022_2023学年新教材高中化学第2章化学键化学反应规律第2节化学反应与能量转化第2课时化学反应能量转化的重要应用__化学电池课件鲁科版必修第二册20220801139pptx、2022_2023学年新教材高中化学第2章化学键化学反应规律第2节化学反应与能量转化第2课时化学反应能量转化的重要应用__化学电池课后习题鲁科版必修第二册20220801238doc、2022_2023学年新教材高中化学第2章化学键化学反应规律第2节化学反应与能量转化第1课时化学反应中能量变化的本质及转化形式课后习题鲁科版必修第二册20220801237doc等4份课件配套教学资源,其中PPT共85页, 欢迎下载使用。
基础落实•必备知识全过关
重难探究•能力素养全提升
学以致用•随堂检测全达标
1.通过生产、生活、实验中的实例,了解化学能与热能的相互转化,建立吸热反应、放热反应的概念,从能量变化的视角发展对化学反应的认识,形成宏观辨识与微观探析的学科核心素养。2.关注与化学有关的社会热点问题,认识提高燃料的燃烧效率、开发高能清洁燃料的重要性,增强节约能源及环境保护等意识,形成科学态度与社会责任的学科核心素养。3.通过认识化学反应中能量变化的实质,进一步深化对化学反应的微观认识。
[知识铺垫]1.化学反应的实质是 断裂, 形成。2.化学反应中旧键的断裂需要 能量,新化学键的生成需要 能量,二者能量差异造成了化学反应中能量的转化。3.甲烷、氢气等可燃物燃烧会 热量。
[必备知识]一、化学反应中的能量变化1.木炭在空气中燃烧,化学能要转化成 和 。2.电解水时 转化为 ,化学能也可以转化成 。
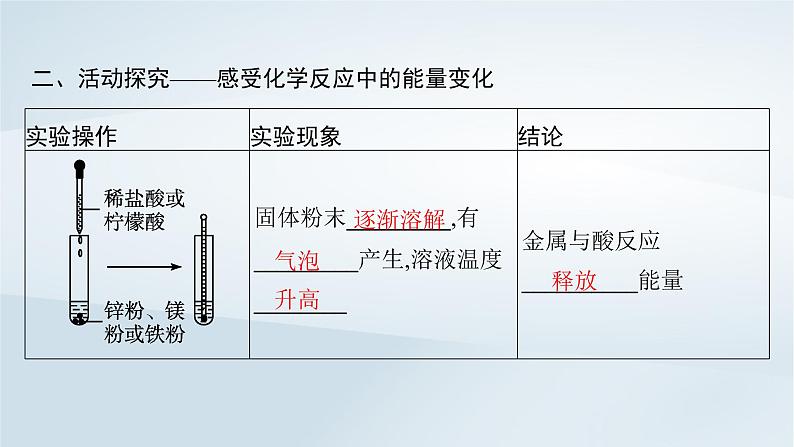
二、活动探究——感受化学反应中的能量变化
结论:化学反应都会伴随 的变化,有的 能量,有的 能量。吸热反应: 热量的化学反应。放热反应: 热量的化学反应。
三、化学反应中能量变化的原因1.从化学键的变化角度分析
E1E2时,反应 能量,反应吸收能量数值= 。
2.从物质所具有的总能量关系分析
反应物总能量>生成物总能量,反应 能量。反应物总能量E总吸,反应释放的能量为930 kJ-685 kJ=245 kJ。
[深化拓展]1.化学反应中能量变化的实质
2.计算公式化学反应中能量的变化ΔQ=反应物的总键能(断开旧键吸收的能量)-生成物的总键能(形成新键放出的能量)。计算得到的值如果是正值,则该反应为吸热反应;如果是负值,该反应为放热反应。
[应用体验]【例2】已知反应H2(g)+I2(g) 2HI(g)中,每生成2 ml HI时会有a kJ的能量放出,已知可逆反应中反应物不能完全反应,又知有关化学键键能如下:下列说法正确的是( )A.1 ml H2的能量比2 ml H(g)的能量高B.将0.5 ml H2与1 ml I2(g)混合充分反应后放出的热量为0.5a kJC.H—I键的键能为0.5(a+b+c)kJ·ml-1D.H(g)+I(g) ―→ HI(g)是吸热变化
答案 C解析 断开化学键需要吸热,即H2 ―→ H+H为吸热过程,则1 ml H2的能量比2 ml H(g)的能量低,A项错误;根据题意,生成2 ml HI时会有a kJ的能量放出,将0.5 ml H2与1 ml I2(g)混合充分反应后生成的HI少于1 ml,则放出的热量少于0.5a kJ,B项错误;反应放出的热量=放出的热量-吸收的热量=H—I键的键能×2-b kJ·ml-1-c kJ·ml-1=a kJ·ml-1,则H—I键的键能为0.5(a+b+c)kJ·ml-1,C项正确;H(g)+I(g) ―→ HI(g)是形成化学键的过程,该过程是放热过程,D项错误。
变式训练2(2021山东烟台高一期末)某反应分两步进行:A→B→C,反应过程中的能量变化曲线如图所示,下列有关叙述错误的是( )
A.三种化合物的稳定性:BC,物质的能量越高越不稳定,因此稳定性:B丙D.氢气和氧气的总能量小于水的能量
答案 C解析 由题图中信息可知,1 ml H2断裂共价键变为2 ml H要吸收436 kJ的能量,0.5 ml O2断裂共价键变为1 ml O要吸收249 kJ的能量,2 ml H和1 ml O结合成1 ml H2O(g)要放出930 kJ的能量,因此可以算出1 ml H2和0.5 ml O2反应生成1 ml H2O(g)要放出245 kJ的能量,同时可知H2O(g)分解为H2与O2时吸收热量。
5.如图所示,把试管放入盛有25 ℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5 mL盐酸于试管中。试回答下列问题:
(1)实验中观察到的现象是 (填字母)。A.试管中镁片逐渐溶解B.试管中产生无色气泡C.烧杯外壁变冷D.烧杯底部析出少量白色固体
(2)试管中发生的反应属于 (填“氧化还原反应”或“非氧化还原反应”)。(3)写出有关反应的离子方程式: 。(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”“小于”或“等于”)镁片和盐酸的总能量。
相关课件
这是一份鲁科版 (2019)必修 第二册第2节 化学反应与能量转化精品ppt课件,共41页。PPT课件主要包含了原电池原理,氧化还原,失去电子,得到电子,传导电荷,传导电子,电势差,得失电子能力,闭合回路,还原剂等内容,欢迎下载使用。
这是一份必修 第二册第2章 化学键 化学反应规律第2节 化学反应与能量转化说课课件ppt,共55页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
这是一份2021学年第2节 化学反应与能量转化教课ppt课件,共53页。PPT课件主要包含了NO1,NO2,学习任务1学习任务2,NO3等内容,欢迎下载使用。








