

2023届高三化学一轮复习 工业流程图 课件
展开核心素养:无机化学工艺流程的分析
化学工艺流程题是近几年高考的热点题型。试题以工农业生产为背景,与产品提纯、环境保护、生产成本等相融合,依托生产流程,考查物质的制备、分离、提纯、检验等。通过识图联题培养学生“宏观辨识与微观探析”素养,结合流程中的初始原料与目的产物分析物质的去向及相关化工措施、化学试剂的选择,培养学生信息提取、加工、整合、运用能力,借助建模手段突破解题的关键,同时帮助学生树立绿色环保的化学理念。
1.读流程图①箭头:进入→投料(反应物) 出去→主产物或副产物(生成物) 返回→ 循环利用物质②三线:主线主产品 副线副产品 回头循环品
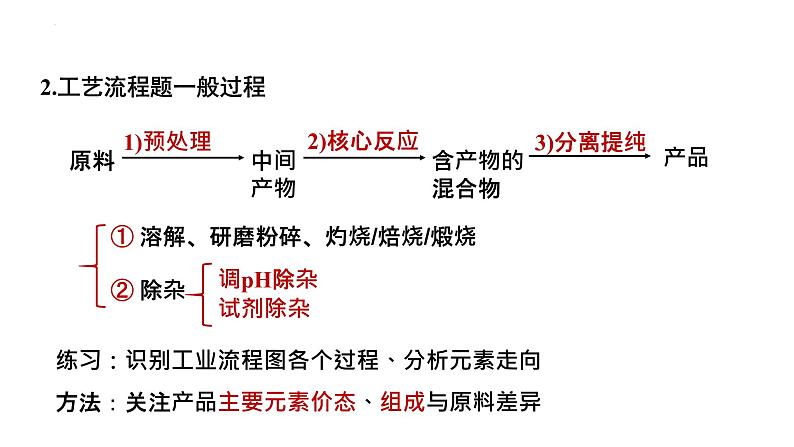
2.工艺流程题一般过程
① 溶解、研磨粉碎、灼烧/焙烧/煅烧
练习:识别工业流程图各个过程、分析元素走向方法:关注产品主要元素价态、组成与原料差异
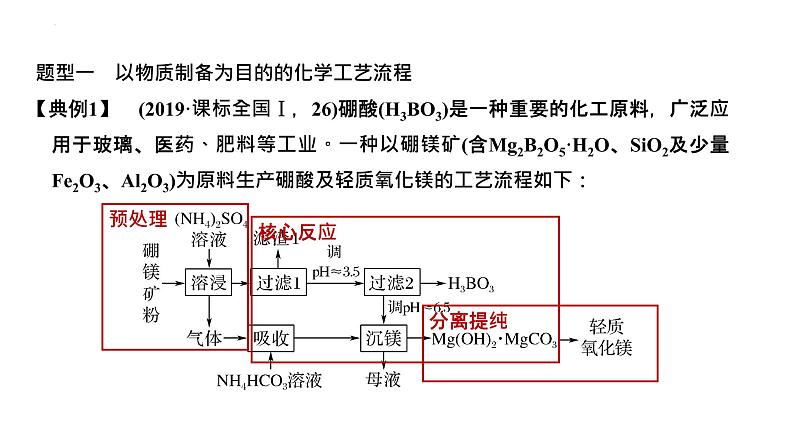
题型一 以物质制备为目的的化学工艺流程
【典例1】 (2019·课标全国Ⅰ,26)硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
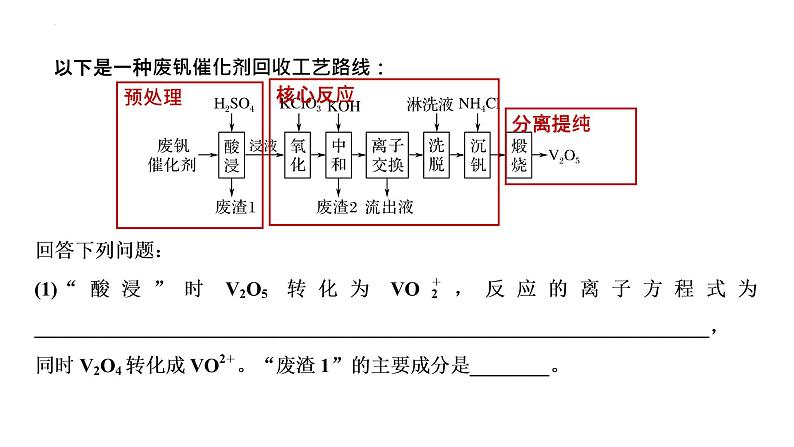
以下是一种废钒催化剂回收工艺路线:
成本 速率 产率 环保
1)预处理①表面处理a.去除表面油污→碱煮水洗(Na2CO3、NaOH)b.去除表面氧化膜→打磨、化学方法②研磨、粉碎、喷洒 增大反应的接触面积、提高反应速率,提高原料的浸取率③浸取a.水浸→分离水溶性和非水溶性物质b.酸浸→可溶金属、金属氧化物、盐等 80%
如何增大反应速率? c T P 催化剂 固体接触面积1)适当增大酸碱的浓度 2)适当增加温度3)搅拌 4)研磨粉碎如何增大浸出率?+5)延长浸取时间
1)预处理③浸取a.水浸→分离水溶性和非水溶性物质b.酸浸→可溶金属、金属氧化物、盐等 80%c.碱浸→除油、溶解铝及其化合物、SiO2等d.醇浸→提取有机物④灼烧a.结构转化→使其能溶于酸碱 如:煅烧高岭土使氧化铝能溶于酸b.除杂→除去可燃性杂质,使元素转化为气体 如:海带提碘,灼烧使有机物转为CO2、H2O 煅烧硫化物,如FeS,使S变为SO2
模板:除去xx(产品)中的xx(杂质)
2)核心反应→方程式书写①信息型离子方程式方法:找前后、判氧还、有四步、管住手找前后:箭头进出→反应物产物管住手:H+ H2O OH- 先别写,最后查H补H2O四步:电子守恒、电荷守恒、质量守恒、补条件(↑、↓、温度)
2)核心反应→方程式书写②生成MCO3的化学方程式Mg2++2HCO3- = MgCO3+CO2↑+H2O
Mg2+ +2HCO3- = MgCO3+CO2↑+H2O
先写离子方程式,在补离子变化学方程式
2013国乙27 锂离子电池的应用很广,其正极材料可再生利用。
(4)写出“沉钴”过程中发生反应的化学方程式 。
CSO4 + 2NH4HCO3 = CCO3 ↓+ (NH4)2SO4 +CO2↑+ H2O
2019国乙26 硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为____________________________________,母液经加热后可返回___________工序循环使用。
2Mg2++2H2O+3CO32-=Mg(OH)2∙MgCO3↓+2HCO3-
2019国丙26高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。(6)写出“沉锰”的离子方程式___________________________________________________。
Mn2++2HCO3-=MnCO3↓+CO2↑+H2O
3)反应条件控制①温度a.增速率→升温,加快反应速率b.防分解→防止XX受热分解 H2O2、NH3·H2O、NaHCO3、HNO3、NaClO或题目信息c.防挥发→防止XX挥发 如:盐酸、氨水、 HNO3、有机试剂d.控水解→抑制XX水解 或促进XX水解,利于…… 如:Fe3+、Al3+e.控平衡→升温,平衡XX移动,转化率/产率XXXf.控溶解→煮沸可除去溶解XX 或 增大XX溶解度 如:水中溶解O2\CO2\Cl2
3)反应条件控制①温度答题模板:Ⅰ.高于X℃ 或 反应需微热、煮沸→加热优点 升温,加快/促进/利于 adefⅡ.低于Y℃→高温弊端 防止 ……分解/挥发/水解 bcdefⅢ.控制在X℃~Y℃→高低温的弊端 低于X℃,反应速率慢 a 高于Y℃, ……分解/挥发/水解 bcdef
3)反应条件控制②控制pHa.使金属阳离子生成沉淀/抑制XX水解
Mx+ → M(OH)x
b.pH范围的确定 杂质离子完全沉淀pH1 产品(其他)离子未开始沉淀 pH2问法:调整pH到pH1 调整pH范围到pH1~pH2
3)反应条件控制②控制pH
b.pH范围的确定 如何出Cu2+中Fe2+?
Cu2+Fe(OH)3
3)反应条件控制c.调pH试剂选择i.消耗溶液中的H+ 考虑产品去处:滤液(再结晶): 不引入杂质滤渣:可引入杂质
ii.调pH大小程度pH=13 NaOH NH3·H2O pH=8 NaOH NH3·H2O
pH=5 Na2CO3
Cu2 (OH)2CO3
沉淀剂:阴离子是杂质沉淀
3)反应条件控制③保护(防氧化)a.产品易被氧化b.添加强还原性试剂
c.充惰性气体答题模板:(排除装置内的空气)防止XX(中的XX元素)被氧化
SO2、SO32-、S2-金属单质Fe、Fe2+酚(胺)、C
混合溶液 aq
蒸发浓缩、冷却结晶、过滤、洗涤、干燥
蒸发结晶、趁热过滤、洗涤
1’KNO3线陡峭2’带结晶水3’受热易分解、水解 铵盐
模板:有利于A析出,防止B析出
操作:较多晶体析出,停止加热
加速过滤/减压过滤 仪器?
4)分离提纯②洗涤a.目的产品状态:滤渣→提高产品纯度 除去晶体表面可溶性杂质,得到更纯净沉淀物滤液→提高产品产率 洗涤滤渣,把有用物质(如目标产物)尽量洗出来
4)分离提纯②洗涤b.洗涤剂选择单剂洗答题模板i.蒸馏水→除去XX表面的杂质xx,提高产品纯度ii.冰水/热水→i除去…… 降低XX的溶解度,减少溶解损失,提高产率iii.饱和XX溶液→i iiiv.有机溶剂→i除去晶体表面的水分 ii降低…… 产品易干燥(酒精75%洗)
4)分离提纯②洗涤b.洗涤剂选择双剂洗答题模板i. 除去XX表面的杂质xx,提高产品纯度ii. 降低XX的溶解度,减少溶解损失,提高产率
蒸馏水冰水/热水饱和XX溶液
i除去晶体表面的水分ii产品易干燥iii防变化(如防生成Na2SO4·10H2O)
4)分离提纯②洗涤c.操作答题模板洗涤:沿玻璃棒向漏斗中注入洗涤剂,至完全浸没沉淀,待溶液自然流下,重复操作2~3次检验“沉淀洗净”:先确定要检验的离子:滤液(沉淀表面)所含最多离子1.取样:取少量最后一次洗涤液于试管中2.加试剂:滴加入XX试剂(必要时加热,如NH4+)3.现象:不产生XX、不变色 4.结论:说明沉淀已经洗涤干净
判断沉淀剂过量的答题规范1.取样:把反应后的混合物静置一段时间,吸取少量上层清液于试管中2.加试剂:滴加少量的沉淀剂3.现象:没有沉淀生成4.结论:说明沉淀剂已过量
5)成分分析滤液r滤渣a.元素走向b.离子进出
方法:关注产品主要元素价态、组成与原料差异
题型二 以物质分离提纯为目的的化学工艺流程
【典例2】 (2016·课标全国Ⅲ,28)以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废矾催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
2024届高三化学工业流程图专题讲座课件: 这是一份2024届高三化学工业流程图专题讲座课件,共49页。PPT课件主要包含了整体意识,两种意识,局部意识,定位意识,原料的预处理措施,反馈练习,萃取分液,产率纯度的计算,产率问题等内容,欢迎下载使用。
2024届高三化学高考备考一轮复习:化学平衡移动 工业合成氨课件: 这是一份2024届高三化学高考备考一轮复习:化学平衡移动 工业合成氨课件,共39页。PPT课件主要包含了正反应方向,不发生,逆反应方向,正反应,逆反应,勒·夏特列原理,升高温度,增大压强,H2的浓度,使用催化剂等内容,欢迎下载使用。
2022届高三化学二轮复习之工业流程 课件: 这是一份2022届高三化学二轮复习之工业流程 课件,共22页。PPT课件主要包含了多孔球泡,2021·河北等内容,欢迎下载使用。