




2023届高三化学高考备考一轮复习 物质的量在化学实验中的应用课件
展开
这是一份2023届高三化学高考备考一轮复习 物质的量在化学实验中的应用课件,共60页。PPT课件主要包含了托盘天平,冷却至室温,液面与刻度线相切等内容,欢迎下载使用。
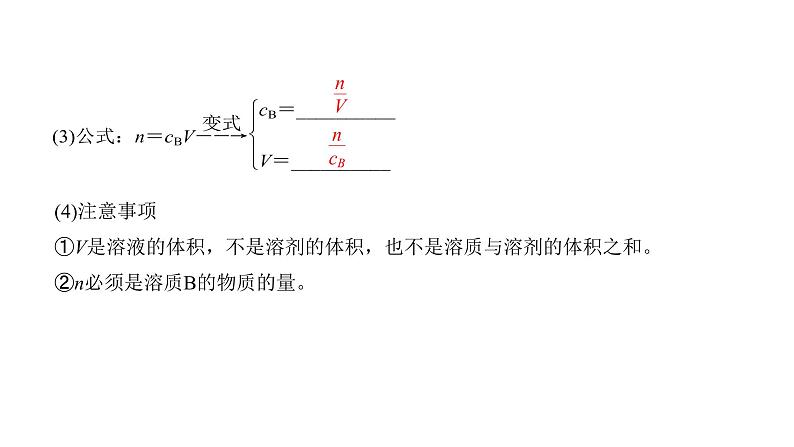
1.物质的量浓度(1)概念物质的量浓度表示____________________里所含溶质B的物质的量,也称为____________________,符号为cB。(2)常用单位:__________或__________。
物质的量浓度及其相关计算
(4)注意事项①V是溶液的体积,不是溶剂的体积,也不是溶质与溶剂的体积之和。②n必须是溶质B的物质的量。
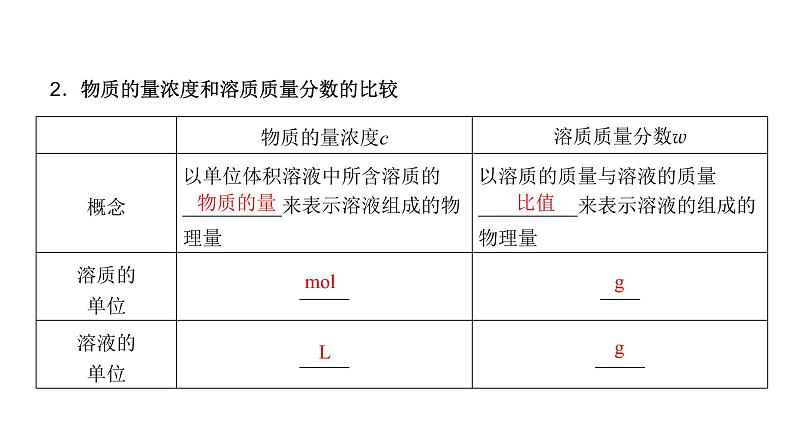
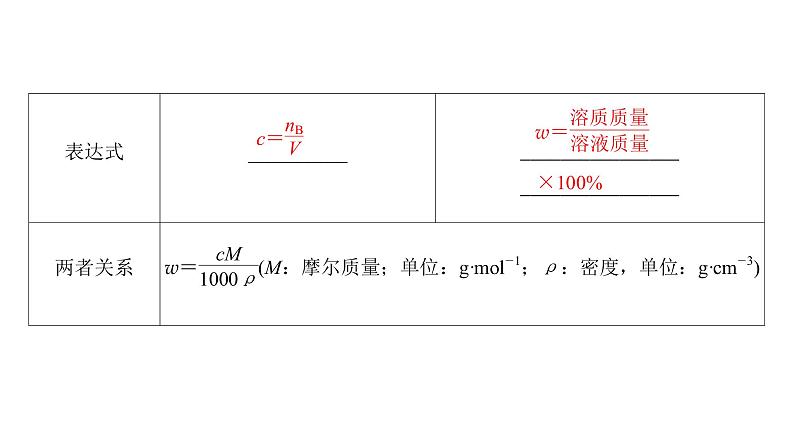
2.物质的量浓度和溶质质量分数的比较
(1)1 ml·L-1NaCl溶液是指此溶液中含有1 ml NaCl。( )(2)从100 mL 5 ml·L-1H2SO4溶液中取出了10 mL,所得硫酸的物质的量浓度为0.5 ml·L-1。( )(3)用100 mL水吸收0.1 ml HCl气体所得溶液的物质的量浓度恰好是1 ml·L-1。( )(4)将62 g Na2O溶于水中,配成1 L溶液,所得溶质的物质的量浓度为1 ml·L-1。( )(5)0.5 ml·L-1的稀H2SO4溶液中c(H+)为1.0 ml·L-1。( )(6)31 g Na2O溶于水,配成1 L溶液,c(Na2O)=0.5 ml·L-1。( )
题点一 对物质的量浓度含义的理解 根据题目条件计算下列溶液的相关量:(1)2 ml·L-1Mg(NO3)2溶液中含有0.4 ml NO,则溶液的体积为________mL。(2)在标准状况下,将V L氨气溶于0.1 L水中,所得溶液的密度为ρ g·cm-3,则此氨水的物质的量浓度为________ml·L-1。(3)若20 g密度为ρ g·cm-3的Ca(NO3)2溶液中含有2 g Ca(NO3)2,则溶液中NO的物质的量浓度为________。
[对点训练1] 下列目的能达到的是( )A.将58.5 g NaCl溶于1 L水中可得1 ml·L-1的NaCl溶液B.从1 L 1 ml·L-1的NaCl溶液中取出10 mL,其浓度仍是1 ml·L-1C.中和100 mL 1 ml·L-1的H2SO4溶液生成正盐,需NaOH 4 gD.将78 g Na2O2溶于水,配成1 L溶液可得到浓度为1 ml·L-1溶液解析:B A项,不知道所得溶液的体积,无法计算NaCl溶液的物质的量浓度;B项,从1 L 1 ml·L-1的NaCl溶液中取出10 mL,其浓度不变;C项,m(NaOH)=2×0.1 L×1 ml·L-1×40 g·ml-1=8 g;D项,所得溶液溶质为NaOH,其浓度应为 2 ml·L-1。
题点二 物质的量浓度与溶质的质量分数之间换算 在环保、化工行业有一种溶液浓度的表示方法:质量—体积浓度,用单位体积溶液中所含的溶质质量来表示,单位g·m-3或g·L-1。现有一种20 ℃时的饱和CuSO4溶液,密度为1.2 g·cm-3,质量—体积浓度为200 g·L-1,则对此溶液的说法错误的是( )A.该溶液的质量分数为16.7%B.该溶液的物质的量浓度为1.25 ml·L-1C.在20 ℃时,硫酸铜的溶解度为20 gD.在20 ℃时把200 g CuSO4·5H2O溶解于1 L水中恰好得到饱和溶液
题点三 溶液的稀释与混合 现有100 mL 1 ml·L-1稀盐酸,欲将其浓度变为2 ml·L-1,可以采取的措施为( )A.向其中通入标准状况下22.4 L HCl气体B.加热蒸发使溶液体积变为50 mLC.加热蒸发掉50 mL水D.加入5 ml·L-1盐酸100 mL,再将溶液体积稀释到300 mL
【解析】 向其中通入标准状况下22.4 L HCl气体,则溶质的物质的量为0.1 L×1 ml·L-1+22.4 L/22.4 L·ml-1=1.1 ml,而溶液体积不能计算,所以其物质的量浓度不能计算,A错误;HCl易挥发,所以加热蒸发稀盐酸,HCl和水蒸气都减少,蒸发操作不可取,故B、C错误;加入5 ml·L-1盐酸100 mL,再将溶液体积稀释到300 mL,所得溶液中溶质物质的量浓度为(0.1 L×1 ml·L-1+5 ml· L-1×0.1 L)/0.3 L=2 ml·L-1,D正确。
[母题变式] 在题干不变的情况下,下列措施正确的是( )A.向其中通入2.24 L HCl气体B.加入100 mL 3 ml/L稀盐酸使总体积变为200 mLC.加热蒸发掉部分水使其密度变为1.85 g·cm-3,质量分数3.65%D.加入200 mL 1 ml/L稀盐酸
[对点训练3] 下图是某学校实验室从市场买回的试剂标签上的部分内容。按要求回答下列问题:(1)硫酸的物质的量浓度为________,氨水的物质的量浓度为________。(2)各取5 mL与等质量的水混合后,c(H2SO4)________9.2 ml·L-1,c(NH3)________6.45 ml·L-1(填“>”“<”或“=”,不同)。(3)各取5 mL与等体积水混合后,w(H2SO4)________49%,w(NH3)________12.5%。
答案:(1)18.4 ml·L-1 12.9 ml·L-1(2)< > (3)> <
1.一定物质的量浓度溶液的配制(1)容量瓶的构造及使用①容量瓶上标有__________、__________和__________。常用规格有100 mL、250 mL、500 mL、1000 mL等。
一定物质的量浓度溶液的配制
2.质量分数及一定质量分数溶液的配制(1)溶质的质量分数①概念:用__________的质量与__________质量的比值来表示溶液组成的物理量,一般用百分数表示。
(3)一定质量分数溶液的配制以配制100 g 5% NaOH溶液为例:①步骤:计算→称量(量取)→溶解(稀释)。②仪器:托盘天平、______________________。
(4)体积比浓度溶液的配制如用浓硫酸配制1∶4的稀硫酸50 mL:用50 mL的量筒量取40.0 mL的水注入100 mL的烧杯中,再用10 mL的量筒量取10.0 mL浓硫酸,然后沿烧杯内壁缓缓注入烧杯中,并用玻璃棒不停地搅拌。
(2)常见的实验误差分析
(1)向容量瓶中转移液体时,引流用玻璃棒可以接触容量瓶内壁。( )(2)洗净的锥形瓶和容量瓶需要放进烘箱中烘干。( )(3)NaOH固体放入小烧杯中,然后加入蒸馏水,为防止氢氧化钠溶液与空气中的CO2反应,溶解后应立即转移到容量瓶中。( )(4)在容量瓶中先加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸。( )(5)用固体NaCl配制0.5 ml·L-1的溶液,所用的仪器只有:烧杯、玻璃棒、胶头滴管、容量瓶。( )
(6)如图A配制0.1 ml·L-1 NaOH溶液。( )(7)如图B配制一定浓度的NaCl溶液。( )(8)用如图C装置配制溶液( )
题点一 一定物质的量浓度溶液的配制 硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·ml-1)可用作定影剂、还原剂。利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:(1)溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在________中溶解,完全溶解后,全部转移至100 mL的________中,加蒸馏水至____________________(2)滴定。
【解析】 溶液配制需要计算、称量、溶解、转移、洗涤、定容、摇匀等步骤,结合配制过程选择需要的仪器,称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至100 mL的容量瓶中,加蒸馏水至凹液面最低处与刻度线相平。【答案】 烧杯 容量瓶 凹液面最低处与刻度线相平
[母题延伸] (1)若将称取的1.2000 g某硫代硫酸钠晶体样品,放入100 mL容量瓶中,加水溶解并稀释至刻度线,该操作正确吗?为什么? (2)向容量瓶中转移液体时,引流用玻璃棒应接触容量瓶内壁的什么位置?为什么?(3)若定容时俯视刻度线,则所配溶液体积偏大还是偏小?此时应如何处理?提示:(1)不正确。容量瓶只用于配制固定体积的溶液,不能用于溶解固体,应在烧杯中溶解再转移到容量瓶。(2)玻璃棒下端应接触容量瓶内壁刻度线以下,防止定容时有部分液体附着在刻度线上,导致所配溶液体积大于100 mL。(3)偏小。应平视,继续加水至溶液凹液面最低处与刻度线相平。
[对点训练1] 实验室需要0.1 ml·L-1 NaOH溶液450 mL和0.5 ml·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:(1)如图所示的仪器中配制溶液肯定不需要的是________(填字母),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)在配制NaOH溶液时:①根据计算用托盘天平称取NaOH的质量为________g;②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________(填“>”“”“
相关课件
这是一份高中化学2 物质的量在化学实验中的应用-课件 2021届高三高考化学一轮复习,共29页。PPT课件主要包含了物质的量浓度,物质的量,molL,随堂练习,概念辨析,常见考查方法,溶质守恒,胶头滴管,刻度线,检查是否漏水等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习第1章化学计量在实验中的应用第2讲物质的量在化学实验中的应用课件
这是一份人教版高考化学一轮复习1.2物质的量在化学实验中的应用课件








