




人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素精品课后练习题
展开姓名: 班级
4.2.2 电解原理的应用
本课重点 | (1)电解原理的应用 |
本课难点 | (2)电解池和原电池的串联 |
一、选择题
1.利用电解法可将含有Fe、Zn、Ag、Au等杂质的粗铜提纯,下列叙述正确的是
A.电解时以纯铜作阳极
B.电解时阴极发生氧化反应
C.粗铜连接电源负极,电极反应是Cu -2e-=Cu2+
D.电解结束,电解槽底部会形成含少量Ag、Au等阳极泥
【答案】D
【解析】A.电解精炼Cu时,以粗铜作阳极,纯铜作阴极,A错误;B.电解时阴极发生得电子的还原反应,B错误;C.粗铜作阳极,连接电源的正极,电极反应有Zn-2e-=Zn2+、Fe-2e-=Fe2+、Cu-2e-=Cu2+,C错误;D.粗铜作阳极,电极反应有Zn-2e-=Zn2+、Fe-2e-=Fe2+、Cu-2e-=Cu2+,粗铜中活泼性不如Cu的Ag、Au不会放电,以阳极泥的形式沉积在电解槽底部,D正确;答案选D。
2.(2017·全国高考真题)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为混合溶液。下列叙述错误的是
A.待加工铝质工件为阳极
B.可选用不锈钢网作为阴极
C.阴极的电极反应式为:
D.硫酸根离子在电解过程中向阳极移动
【答案】C
【解析】A、根据原理可知,Al要形成氧化膜,化合价升高失电子,因此铝为阳极,说法正确;B、不锈钢网接触面积大,能增加电解效率,说法正确;C、阴极应为阳离子得电子,根据离子放电顺序应是H+放电,即2H++2e-=H2↑,说法错误;D、根据电解原理,电解时,阴离子移向阳极,说法正确。
3.(2011·上海高考真题)用电解法提取氯化铜废液中的铜,方案正确的是( )
A.用铜片连接电源的正极,另一电极用铂片
B.用碳棒连接电源的正极,另一电极用铜片
C.用氢氧化钠溶液吸收阴极产物
D.用带火星的木条检验阳极产物
【答案】B
【解析】A.在铂电极上电镀铜,无法提取铜,错误;B.利用电解法提取CuCl2溶液中的铜,阴极应发生反应:Cu2++2e-=Cu,阳极可以用碳棒等惰性材料作电极,正确;C.电解时阴极产生铜,无法用NaOH溶液吸收,错误;阳极反应:2Cl--2e-=Cl2↑,无法用带火星的木条检验,错误;答案选B。
4.(2020·浙江高考真题)在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )
离子交换膜
A.电极A为阳极,发生氧化反应生成氯气
B.离子交换膜为阳离子交换膜
C.饱和NaCl从a处进,NaOH溶液从d处出
D.OH-迁移的数量等于导线上通过电子的数量
【答案】D
【解析】氯碱工业中的总反应为2Cl-+2H2O 2OH-+H2↑+Cl2↑;电解池中阳极失电子发生氧化反应,氯碱工业中Cl2为氧化产物,所以电极A为阳极,电极B为阴极,据此作答。A.根据分析可知电极A为阳极,发生氧化反应生成氯气,正确;B.阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:H2O+2e-═H2↑+2OH-;为了防止生成的氯气与氢氧化钠发生反应,氢氧化钠要从d口流出,所以要防止OH-流向阳极即电极A,该离子交换膜为阳离子交换膜,正确;C.根据B选项的分析可知饱和NaCl从a处进,NaOH溶液从d处出,正确;D.因为有离子交换膜的存在,OH-不发生迁移,错误;故答案为D。
5.(2021·江苏沭阳·高二期中)餐具表面镀银可达到增强抗腐蚀性、提升美观等目的。下列关于铁表面镀银的说法不正确的是
A.电路中每通过1mole-,阴极析出1mol银
B.铁电极应与电源负极相连
C.阳极电极反应式为Ag﹣e- = Ag+
D.电镀液需要不断更换
【答案】D
【详解】
A.阴极发生反应Ag++e-=Ag,故每通过1mole-析出1mol银,A正确;
B.铁为镀件,应与电源负极相连,故B正确;
C.阳极为镀层金属,电极反应式为Ag﹣e- = Ag+,故C正确;
D.阳极发生反应为Ag﹣e- = Ag+,阴极发生反应Ag++e-=Ag,电镀液浓度不变,不需要更换,故D错误;
故选D。
6.(2021·江苏沭阳·高二期中)2021年6月17日,搭载神舟十二号载人飞船的长征二号F遥十二运载火箭成功发射,并顺利完成与天和核心舱对接。火箭采用偏二甲肼(C2H8N2)/N2O4发动机,核心舱电源系统由锂离子蓄电池组以及三结砷化镓(GaAs)太阳电池翼组成。氮化硼(BN)陶瓷基复合材料应用于核心舱电推进系统,碳化硅(SiC)颗粒增强铝基复合材料应用于太阳电池翼伸展机构关键部件,表面处理后镁合金部件应用在核心舱医学样本分析与高微重力科学实验柜中。锂离子蓄电池放电时的反应如下:LixC6 + Li(1-x)CoO2 = LiCoO2 + 6C(x<1)。下列说法正确的是
A.放电时,Li+在电解质中由正极向负极迁移
B.放电时,Li(1-x)CoO2中Co元素的化合价不发生变化
C.充电时,阴极电极反应式为:xLi++6C+xe- = LixC6
D.充电时,阳极发生还原反应
【答案】C
【分析】
锂离子蓄电池的反应是LixC6 + Li(1-x)CoO2 = LiCoO2 + 6C(x<1),根据原电池的工作原理,负极反应式为LixC6-xe-=xLi++6C,正极反应式为Li(1-x)CoO2+xe-+xLi+=LiCoO2,据此分析解答。
【详解】
A.根据原电池工作原理,Li+从负极向正极迁移,故A错误;
B.根据上述分析,Co得电子,化合价降低,故B错误;
C.充电时,电池的负极接电源的负极,充电时,阴极反应式为放电时负极反应式的逆过程,即阴极反应式为xLi++6C+xe- = LixC6,故C正确;
D.充电时,电池正极接电源的正极,根据电解原理,阳极上失电子,化合价升高,发生氧化反应,故D错误;
答案为C。
7.(2021·河北·唐山一中高二期中)连二亚硫酸钠()俗称保险粉,是一种强还原剂。工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠。原理及装置如图所示,下列说法不正确的是
A.电路中每转移1mol电子,消耗的体积为11.2L
B.a电极的电极反应式
C.装置中所用离子交换膜为阳离子交换膜
D.b电极应该接电源的正极
【答案】A
【详解】
A.未说明气体状况是否为标况下,无法计算气体体积,A项错误;
B.由图可知,a电极上转化为,电极反应式为,B项正确;
C.a电极的电极反应式为,b电极的电极反应式为,b电极生成的移向a电极,则装置中所用离子交换膜为阳离子交换膜,C项正确;
D.b电极的电极反应式为,发生氧化反应,b电极为阳极,接电源的正极,D项正确;
答案选A。
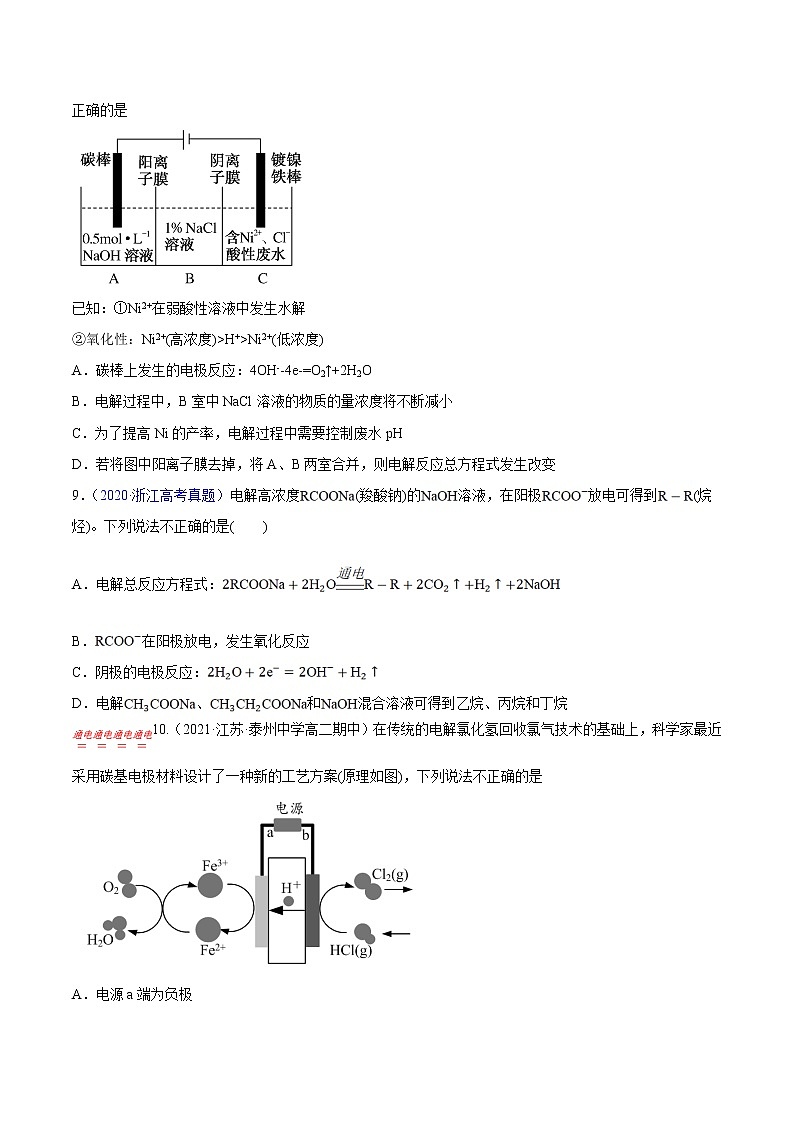
8.(2021·全国·高二期末)工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A.碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B.电解过程中,B室中NaCl溶液的物质的量浓度将不断减小
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
【答案】B
【详解】
A.根据图示,碳棒是阳极发生氧化反应,碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O,故A正确;
B.电解过程中,Na+由A进入B,氯离子由C进入B,B室中NaCl溶液的物质的量浓度将不断增大,故B错误;
C.氧化性: H+>Ni2+(低浓度),为防止氢离子在阴极放电,提高Ni的产率,电解过程中需要控制废水pH,故C正确;
D.若将图中阳离子膜去掉,将A、B两室合并,阳极氯离子失电子生成氯气,则电解反应总方程式发生改变,故D正确;
选B。
9.(2020·浙江高考真题)电解高浓度(羧酸钠)的溶液,在阳极放电可得到(烷烃)。下列说法不正确的是( )
A.电解总反应方程式:
B.在阳极放电,发生氧化反应
C.阴极的电极反应:
D.电解、和混合溶液可得到乙烷、丙烷和丁烷
【答案】A
【解析】A.因为阳极RCOO-放电可得到R-R(烷烃)和产生CO2,在强碱性环境中,CO2会与OH-反应生成CO32-和H2O,故阳极的电极反应式为2RCOO--2e-+4OH-=R-R+2CO32-+2H2O,阴极上H2O电离产生的H+放电生成H2,同时生成OH-,阴极的电极反应式为2H2O+2e-=2OH-+H2↑,因而电解总反应方程式为2RCOONa+2NaOHR-R+2Na2CO3+H2↑,不正确;B.RCOO-在阳极放电,电极反应式为2RCOO--2e-+4OH-=R-R+2CO32-+2H2O, -COO-中碳元素的化合价由+3价升高为+4价,发生氧化反应,烃基-R中元素的化合价没有发生变化,正确;C.阴极上H2O电离产生的H+放电生成H2,同时生成OH-,阴极的电极反应为2H2O+2e-=2OH-+H2↑,正确;D.根据题中信息,由上述电解总反应方程式可以确定下列反应能够发生:2CH3COONa+2NaOHCH3-CH3+2Na2CO3+H2↑,2CH3CH2COONa+2NaOHCH3CH2-CH2CH3+2Na2CO3+H2↑,CH3COONa+CH3CH2COONa+2NaOHCH3-CH2CH3+2Na2CO3+H2↑。因此,电解CH3COONa、CH3CH2COONa和NaOH 的混合溶液可得到乙烷、丙烷和丁烷,正确。答案为A。
10.(2021·江苏·泰州中学高二期中)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案(原理如图),下列说法不正确的是
A.电源a端为负极
B.Fe3+对总反应起催化作用
C.阳极发生的电极反应式为2HCl-2e-=2H++Cl2
D.电路中转移1mol电子,需要消耗11.2LO2(标准状况)
【答案】D
【详解】
A.根据图示,a端,发生还原反应,所以a端为电源负极,故A正确;
B.根据图示,、,a端总反应为,所以Fe3+对总反应起催化作用,故B正确;
C.根据图示,阳极发生的电极反应式为2HCl-2e-=2H++Cl2,故C正确;
D.阴极反应为,电路中转移1mol电子,根据电子守恒,需要消耗5.6LO2(标准状况),故D错误;
选D。
11.(2021·福建宁德·高二期中)图形电镀具备导体图形侧生长小、线条边缘陡直、图形分辨率高等优点,广泛应用于微带电路制作。板件经过贴膜曝光显影后形成一定的线路,图形电镀就是针对干膜没有覆盖的铜面进行选择性加厚和保护。工艺主要流程和电镀原理如图所示,下列说法一定错误的是
A.“除油”是把油污等有机物及其他残余物除去使板面干净光洁
B.“水洗”是除去PCB板上残留的溶液避免对下个步骤产生干扰
C.“微蚀”粗化铜面表面反应原理为Na2S2O8 + Cu = CuSO4 + Na2SO4
D.“镀铜”时PCB板为阴极,发生的电极方程式为Cu-2e-= Cu2+
【答案】D
【详解】
A.“除油”是在酸性条件下把油污等有机物发生水解反应而溶解除去,及其他残余物除去使板面干净光洁,以便后续铜的电镀,A正确;
B.水洗”是除去PCB板多余的Na2S2O8,防止其与铜单质反应,B正确;
C.“微蚀”粗化铜面表面加入Na2S2O8具有氧化性,可与铜反应生成硫酸铜,反应原理为Na2S2O8 + Cu = CuSO4 + Na2SO4,C正确;
D.“镀铜”时PCB板为阳极,发生的电极方程式为Cu-2e-= Cu2+,D错误;
故选:D。
12.(2021·福建三明·高二期中)液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图甲所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。以该燃料电池为电源电解足量饱和CuCl2溶液的装置如图乙所示。下列说法错误的是
A.甲中b电极为正极
B.理论上当燃料电池消耗0.15molO2时,乙中c电极增重19.2g
C.a电极的电极反应式为:N2H4-4e−+4OH−=N2+4H2O
D.燃料电池甲中OH−通过阴离子交换膜向a电极方向移动
【答案】B
【分析】
甲为燃料电池,负极上燃料失电子发生氧化反应,则左侧a电极为负极,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,正极上氧气得电子发生还原反应,右侧b电极为正极,电极反应式为:O2+2H2O+4e-=4OH-,乙为电解池,与a电极相连的d电极为阴极,铜离子得电子发生还原反应,与b电极相连的c电极为阳极,氯离子失电子发生氧化反应,结合离子的移动方向、转移电子数相等分析解答。
【详解】
A.根据以上分析,甲中b电极称为正极,故A正确;
B.乙为电解池,与a电极相连的d电极为阴极,铜离子得电子发生还原反应析出铜,根据转移电子数相等,当燃料电池消耗0.15molO2时,乙中d电极增重0.15×2×64=19.2g,故B错误;
C.根据分析可知甲为燃料电池,负极上燃料失电子发生氧化反应,则左侧a电极为负极,电极反应式为:N2H4+4OH--4e-=N2↑+4H2O,故C正确;
D.原电池中阴离子移向负极,故OH−通过阴离子交换膜向a电极方向移动,故D正确;
故答案为B。
13.(2021·浙江温州·高二期中)甲烷燃料电池以铂为电极材料,两极分别通入CH4和O2,电解质溶液为KOH溶液。将两个甲烷燃料电池串联后作为电源,用石墨电极电解饱和食盐水。下列说法不正确的是
A.电解过程中,a电极上产生Cl2
B.电解池中阴极反应式为:
C.甲烷燃料电池负极反应式为:
D.当每个甲烷燃料电池都消耗2.24L时,理论上可产生0.8molCl2
【答案】D
【分析】
根据题意以及装置图,左边两个装置为燃料电池,通甲烷一极为负极,通氧气一极为正极,最右边装置为电解池,电极a连接电源的正极,电极a为阳极,电极b为阴极,据此分析;
【详解】
A.根据上述分析,电极a为阳极,根据电解原理,电极a的电极反应式为2Cl--2e-=Cl2↑,故A说法正确;
B.电极b为阴极,根据电解原理,电极b电极反应式为2H2O+2e-=2OH-+H2↑,故B说法正确;
C.通甲烷一极为负极,电解质为KOH溶液,因此负极反应式为,故C说法正确;
D.题中没有指明是否是标准状况,因此无法计算产生氯气的物质的量,故D说法错误;
答案为D。
二、非选择题
14.(2021·福建省厦门第六中学高二期中)一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。回答下列问题:
(1)甲为电源的___极。
(2)乙极的电极反应式为___,丁极的电极反应式为___。
(3)KOH溶液的质量分数,将a%、b%、c%由大到小排序___。
(4)标准状况下,甲电极上每消耗22.4L气体时,理论上阳极区减轻质量__g,阴极区产生___molOH-。
【答案】(1)正
(2) H2-2e-+2OH-=2H2O -e-=
(3)c%>b%>a%
(4) 156 4
【分析】分析装置的特点,可知左边是燃料电池,右边是电解池;通入氧气的电极甲是电池的正极,电极反应为:O2+4e-+2H2O=4OH-,与甲相连的电极丁是电解池的阳极,则丁电极上被氧化为;丙电极是电解池的阴极,溶液中氢离子在阴极被还原为氢气,电极反应为:2H2O+2e-=2OH-+H2↑,所以气体X是氢气,电极乙的电极反应为:H2-2e-+2OH-=2H2O,据此分析解题。
(1)由分析可知,通入氧气的电极甲是电池的正极,故答案为:正;
(2)由分析可知,乙极为电源的负极,X物质为H2,故电极反应式为H2-2e-+2OH-=2H2O,丁极与电源的正极相连,是阳极,该电极的电极反应式为-e-=,故答案为:H2-2e-+2OH-=2H2O;-e-=;
(3)丙电极为阴极,电极反应为2H2O+2e-=2OH-+H2↑,甲电极的反应式为O2+2H2O+4e-=4OH-,乙电极的反应式为H2+2OH--2e-=2H2O,则甲电极附近始终生成KOH并且不消耗,所以c%>b%,丙电极附近也始终生成KOH,所以b%>a%,故大小关系为c%>b%>a%,故答案为:c%>b%>a%;
(4)标准状况下,甲电极每消耗22.4L即=1mol氧气时,转移4mol电子,所以理论上有4molK+进入阴极区,则阳极区质量较少了4mol×39g/mol=156g,根据电极反应2H2O+2e-=2OH-+H2↑和电子守恒可知,阴极区产生4molOH-,故答案为:156;4。
15.(2021·安徽宿州·高二期中)按要求填空:
(1)对烟道气中的SO2进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下由SO2和CO反应生成S和CO2的能量变化如图所示,若反应中有48g S(s)生成,则该反应___________(填“放出”或“吸收”)的热量为___________。
(2)汽车尾气中排放的NOx和CO污染环境,在汽车尾气中安装催化转化器,可有效降低NOx和CO的排放。已知:
a.2CO(g)+O2(g)2CO2(g) ∆H=-566.0kJ·mol-1
b.N2(g)+O2(g)2NO(g) ∆H=+180.5kJ·mol-1
回答下列问题
①CO的燃烧热为___________。
②CO将NO还原为N2的热化学方程式为___________。
(3)电解法处理氮氧化物废气有较高的环境效益和经济效益(图中电极均为石墨)。电解NO2制备NH4NO3原理如图所示。阳极为___________(填“X”或“Y”),Y的电极反应式为___________。
【答案】(1)放出 405kJ (2)283.0kJ/mol 2CO(g)+ 2NO(g) 2CO2(g)+ N2(g) ∆H=-746.5kJ·mol-1
(3)X NO2-e-+H2O=NO+2H+
【解析】(1)根据图象分析,反应物总能量高于生成物总能量,则反应为放热反应,正逆反应活化能之差为反应放出的热量,则生成32 g S(s)放出热量为270kJ,生成48g S(s)放出405kJ;
(2)已知2CO(g)+O2(g)2CO2(g) ∆H=-566.0kJ·mol-1,可知1molCO完全燃烧生成1molCO2时释放的能量为:566.0 kJ /2=283.0kJ,则CO的燃烧热为283.0kJ/mol;
②根据盖斯定律,反应a-b得到2CO(g)+ 2NO(g) 2CO2(g)+ N2(g) ∆H=-746.5kJ·mol-1;
(3)电解NO2制备NH4NO3时,在阳极上是X极NO2失电子的氧化反应,电极反应式为:NO2-e-+H2O=NO+2H+。
高中化学人教版 (2019)选择性必修1第二节 电解池同步测试题: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002435_t7/?tag_id=28" target="_blank">第二节 电解池同步测试题</a>,共27页。试卷主要包含了下列关于电解的说法错误的是,下列有关工业生产的叙述正确的是等内容,欢迎下载使用。
人教版 (2019)选择性必修1第四章 化学反应与电能第二节 电解池巩固练习: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002435_t7/?tag_id=28" target="_blank">第四章 化学反应与电能第二节 电解池巩固练习</a>,共25页。试卷主要包含了下列说法正确的是,图中两个装置,有关叙述正确的是,C2可用于化学镀钴等内容,欢迎下载使用。
2020-2021学年实验活动1 探究影响化学平衡移动的因素精品同步达标检测题: 这是一份2020-2021学年实验活动1 探究影响化学平衡移动的因素精品同步达标检测题,文件包含431电解原理-2022-2023学年高二化学课后培优练人教版选修4解析版doc、431电解原理-2022-2023学年高二化学课后培优练人教版选修4原卷版doc等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。













