




人教版 (2019)选择性必修1第二节 化学平衡优秀课后复习题
展开姓名: 班级
第二章 化学反应速率和化学平衡
第三节 化学平衡
课时2 影响化学平衡状态的因素
重点 | 1.明确化学平衡移动的含义,会根据反应速率的变化判断化学平衡的移动方向。 2.通过实验探究,认识外界条件(浓度、温度、压强等)对化学平衡的影响规律。 |
1.(2021·河南高二期末)某已平衡的化学可逆反应,下列有关叙述正确的是
A.使用合适的催化剂可以使平衡正向移动
B.升高温度,平衡一定正向移动
C.增加生成物的质量,平衡一定逆向移动
D.有气体参加的可逆反应,减小体积增大压强能够加快反应速率
2.(2020·贵州高二学业考试)反应Fe3++3SCN-Fe(SCN)3达到平衡后,其他条件不变时,下列措施能使平衡向正反应方向移动的是
A.增大Fe3+浓度 B.减小SCN-浓度
C.增大Fe(SCN)3浓度 D.滴加NaOH溶液
3.(2021·云南省楚雄天人中学)对已达平衡的下列反应:3A(g)+B(g)⇌2C(g)+2D(g),若增大压强,则所产生的影响正确的是
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正、逆反应速率都增大,平衡不发生移动
C.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
4.(2020·湖北高二期中)下列变化不能用勒夏特列平衡移动原理释解的是
A.工业生产硫酸的过程中使用适当过量的氧气,以提高二氧化硫的转化率
B.红棕色的NO2加压后颜色先变深再变浅
C.光照新制的氯水,溶液的酸性增强
D.工业合成氨的反应,往往需要使用催化剂
5.(2021·广西桂林市·高二期末)可逆反应,反应过程中的百分含量与温度(T)的关系如图所示,下列叙述中正确的是
A.温度:
B.平衡后,使用催化剂,将增大
C.平衡后,升高温度,平衡向逆反应方向移动
D.平衡后,增加的量,化学平衡向正反应方向移动
6.(2021·江苏宿迁市·高二期末)“蓝天保卫战”需要持续进行大气治理,有效处理SO2、NO2等大气污染物。化学研究为生产、生活处理废气,防止大气污染做出重要贡献。已知反应: ,运用该反应处理废气时有关说法正确的是
A.增大压强有利于反应自发进行 B.该反应不能完全消除废气
C.降低反应温度可提高去除效率 D.升高反应温度可提高废气转化率
7.(2021·江苏南京市·高二期末)NO2与N2O4能相互转化,热化学方程式为N2O4(g)⇌2NO2(g) ΔH=57kJ·mol-1,下列有关说法不正确的是
A.升高体系温度正反应速率增大,逆反应速率减小
B.若容器体积不变,气体颜色不变时说明该反应建立化学平衡
C.其它条件不变,向平衡后的容器中再加入少量NO2,的值不变
D.其他条件不变,减小体系的压强会提高N2O4的转化率
8.(2020·大连市普兰店区第一中学高二月考)在恒温恒容条件下,能使A(g)+B(g) C(g)+D(g)逆反应速率增大且平衡向右移动的措施是
A.减小C的浓度 B.增大D的浓度 C.减小B的浓度 D.增大A的浓度
9.(2021·东台创新高级中学高二月考)对于反应2SO2(g)+O2(g)2SO3(g),下列有关说法不正确的是
A.使用催化剂能缩短该反应到达平衡的时间
B.升高温度有利于提高SO2的平衡转化率
C.提高的值可增大SO2的转化率
D.增大体系的压强能提高SO2的反应速率和转化率
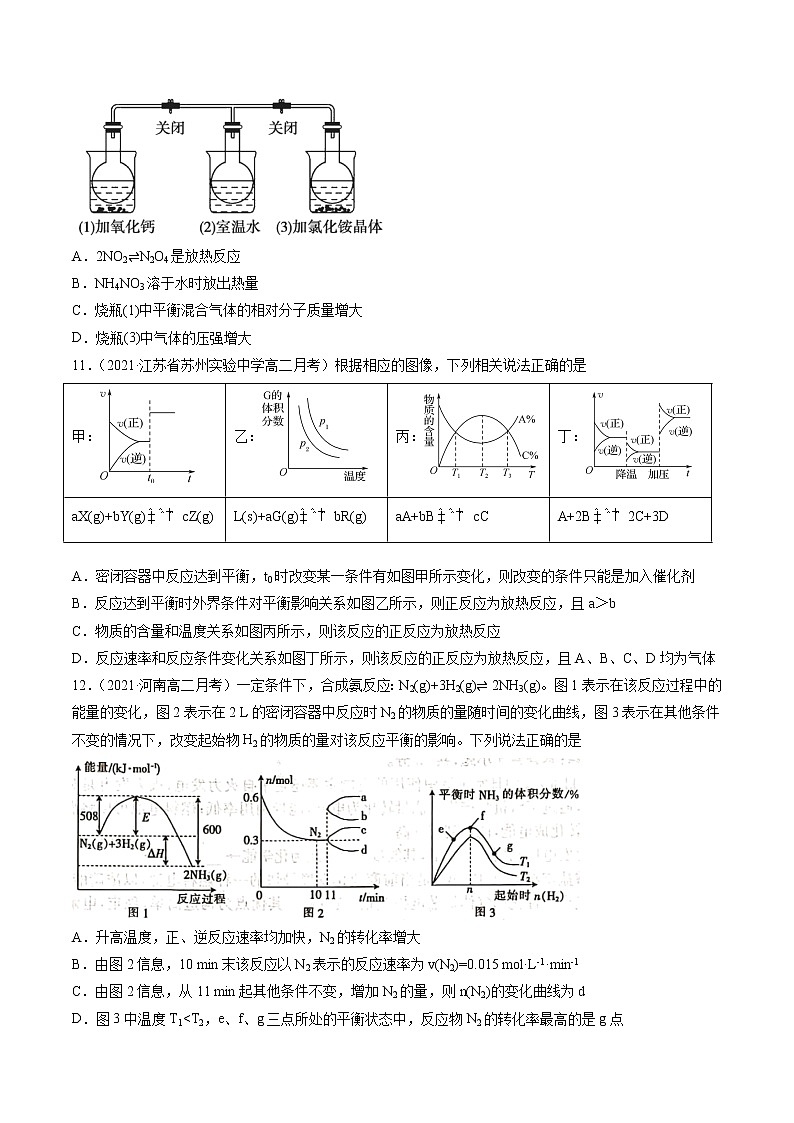
10.(2020·福建莆田市·莆田二中高二期中)如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4NO3晶体,发现(1)中红棕色变深,(3)中红棕色变浅[已知反应2NO2(红棕色)⇌N2O4(无色)]。下列叙述正确的是
A.2NO2⇌N2O4是放热反应
B.NH4NO3溶于水时放出热量
C.烧瓶(1)中平衡混合气体的相对分子质量增大
D.烧瓶(3)中气体的压强增大
11.(2021·江苏省苏州实验中学高二月考)根据相应的图像,下列相关说法正确的是
甲: | 乙: | 丙: | 丁: |
aX(g)+bY(g)cZ(g) | L(s)+aG(g)bR(g) | aA+bBcC | A+2B2C+3D |
A.密闭容器中反应达到平衡,t0时改变某一条件有如图甲所示变化,则改变的条件只能是加入催化剂
B.反应达到平衡时外界条件对平衡影响关系如图乙所示,则正反应为放热反应,且a>b
C.物质的含量和温度关系如图丙所示,则该反应的正反应为放热反应
D.反应速率和反应条件变化关系如图丁所示,则该反应的正反应为放热反应,且A、B、C、D均为气体
12.(2021·河南高二月考)一定条件下,合成氨反应:N2(g)+3H2(g)⇌ 2NH3(g)。图1表示在该反应过程中的能量的变化,图2表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线,图3表示在其他条件不变的情况下,改变起始物H2的物质的量对该反应平衡的影响。下列说法正确的是
A.升高温度,正、逆反应速率均加快,N2的转化率增大
B.由图2信息,10 min末该反应以N2表示的反应速率为v(N2)=0.015 mol·L-1·min-1
C.由图2信息,从11 min起其他条件不变,增加N2的量,则n(N2)的变化曲线为d
D.图3中温度T1<T2,e、f、g三点所处的平衡状态中,反应物N2的转化率最高的是g点
13.(2021·沂源县第二中学高二期中)在密闭容器中的一定量混合气体发生反应:xA(s)+yB(g)zC(g)+wD(g),平衡时测得C的浓度为0.50 mol·L-1,保持温度不变,将容器的容积压缩到原来的1/2,再达平衡时,测得C的浓度升高为0.80 mol·L-1.下列有关判断正确的是
A.增加A的量平衡正向移动 B.x+y<z+w
C.D的浓度减小 D.B的转化率减小
14.(2021·浙江高二月考)在平衡体系: CaCO3(s)CaO(s) +CO2(g)中仅含有CaCO3、CaO及CO2气体。原压强为P,体积为V,在t0时刻,将容器体积缩小为原来的一半并保持不变。 若固体所占体积可忽略,且温度维持不变,测得此体系中压强(P纵坐标)跟时间(t横坐标)的关系如图所示,下列说法不正确的是
A.该反应的平衡常数Kp=p (CO2)
B.容器体积缩小,CO2浓度增大,平衡向左移动
C.t1时,CaO反应完全
D.t1时,若再加入足量的CaO,达到新平衡时体系的压强大于P
15.(2020·江西省兴国县第三中学)温度、容积相同的3个密闭容器,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表[已知N2 (g)+3H2 (g)⇌2NH3 (g) ΔH=-92.4 kJ·mol-1]:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、3 molH2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓度(mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.α1+α3>1
16.在密闭容器中,使2molN2和6 mol H2混合发生下列反应:N2(g)+3H2(g)⇌2NH3(g) ΔH<0。
(1)当反应达到平衡时,N2和H2的浓度比是_______;N2和H2的转化率比是_______。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量_______,密度_______(填“变大”、“变小”或“不变”)。
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将_______(填“正向”、“逆向”或“不”)移动。
17.(2020·四川省蒲江县蒲江中学高二月考)以下是关于“外界因素对化学平衡移动影响的实验研究”的课题,回答问题:
(1)影响化学平衡因素的界定:化学平衡发生移动的本质原因是_______,所以影响化学平衡的因素可以从分析影响速率的因素入手。
a.V(正)≠V(逆) b.V(正)和V(逆)都增大 c.V(正)和V(逆)都减小
(2)研究的思路与方法
①研究对象的选择,现有以下可逆反应:
A.2NO2(g)⇌N2O4 (g) ∆H<0 B.FeCl3+3KSCN ⇌Fe(SCN)3+3KCl
其中,A适合于研究_______对平衡的影响,B适合于研究_______对平衡的影响。
a.浓度 b.压强 c.温度 d.催化剂
②研究方法:采用控制其他因素不变,改变其中一个因素的方法,并进行对比实验。
(3)单一因素对化学平衡移动影响的实验研究:
①浓度:将FeCl3与KSCN反应后所得的混合液分为2等份,分别加入浓FeCl3溶液和NaOH固体,观察现象。现象:加入浓FeCl3溶液后的混合溶液红色_______,加入NaOH固体后,混合溶液的红色_______。
②温度:将密封并相互连通的盛有NO2的两个玻璃球,一个放人热水中,另一个放入冷水中。现象:放入热水中的球内红棕色_______;放入冷水中的球内红棕色_______。
18.(2020·河北武强中学高二月考)向一个固定体积的密闭容器充入2molA和1molB,发生如下反应:2A(g)+B(g)3C(g)+D(g),2分钟后,反应达到平衡,C的浓度为1.2mol/L。
(1)用A表示2分钟内平均反应速率为___________。
(2)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为___________(填“吸热”或“放热”)反应。
(3)增大B的转化率,可采取的措施是___________(用序号填空)
①加入A ②加入B ③加压 ④再加入1.6molA+0.8molB ⑤将C分离出容器
(4)若在一体积可变的容器中,该反应达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况如下图,a点改变的条件可能是___________;若升高温度时,请将反应速率变化情况画在c-d处。___________
19.(2021·江苏苏州市·高二期中)为探讨化学平衡移动原理与氧化还原反应规律的联系,小睿同学通过改变浓度研究:“”反应中Fe3+和Fe2+的相互转化。实验如下:
(1)待实验①溶液颜色不再改变时,再进行实验②③④,目的是使实验①的反应达到_______。
(2)实验④是实验③的_______试验,目的是_______。
(3)实验②的颜色变化表明平衡逆向移动,Fe2+向Fe3+转化。根据氧化还原反应的规律,该同学推测实验②中Fe2+向Fe3+转化的原因:外加Ag+使c(I-)降低,导致的还原性弱于Fe2+,用如图装置(a、b均为石墨电极)进行实验验证。
①K闭合时,指针向右偏转,b作_______极。
②当指针归零(反应达到平衡)后,向U型管左管滴加0.01 mol/LAgNO3溶液,产生的现象证实了其推测,该现象是_______。
(4)按照(3)的原理,该同学用上图装置再进行实验,证实了实验③中Fe2+向Fe3+转化的原因。
①转化原因是_______。
②与(3)实验对比,不同的操作是_______。
(5)实验①中,还原性:I->Fe2+,而实验②③中,还原性:Fe2+>I-,将(3)和(4)作对比,得出的结论是_______。
人教版 (2019)选择性必修1第二节 化学平衡课时练习: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002420_t7/?tag_id=28" target="_blank">第二节 化学平衡课时练习</a>,共22页。试卷主要包含了已知反应,在溶液中存在平衡等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡实验活动3 盐类水解的应用精品达标测试: 这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡实验活动3 盐类水解的应用精品达标测试,文件包含332影响盐类水解的主要因素-2022-2023学年高二化学课后培优练人教版选修4解析版doc、332影响盐类水解的主要因素-2022-2023学年高二化学课后培优练人教版选修4原卷版doc等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素精品同步达标检测题: 这是一份高中化学人教版 (2019)选择性必修1实验活动1 探究影响化学平衡移动的因素精品同步达标检测题,文件包含233化学平衡常数-2022-2023学年高二化学课后培优练人教版选修4解析版doc、233化学平衡常数-2022-2023学年高二化学课后培优练人教版选修4原卷版doc等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。













