



高中专题3 从海水中获得的化学物质第二单元 金属钠及钠的化合物教学ppt课件
展开课程目标1.了解碳酸钠的性质、制法和应用。2.了解碳酸氢钠的主要性质及应用。图说考点
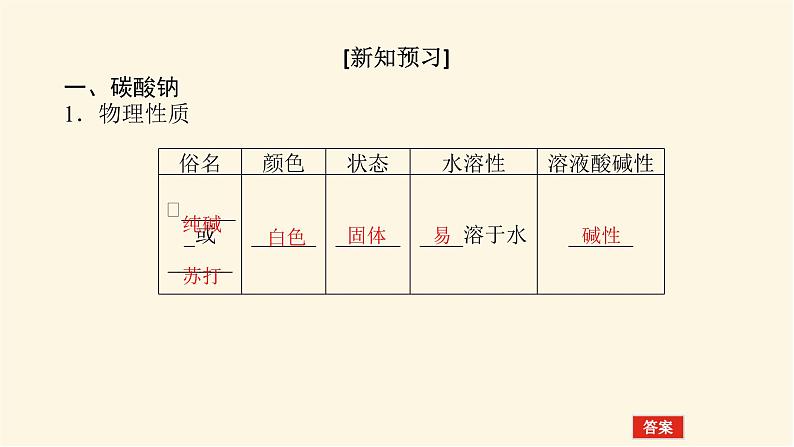
[新知预习]一、碳酸钠1.物理性质
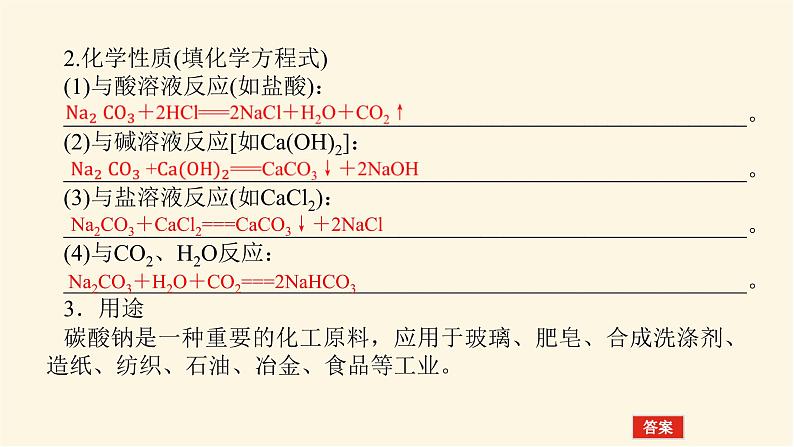
2.化学性质(填化学方程式)(1)与酸溶液反应(如盐酸):___________________________________________________________。(2)与碱溶液反应[如Ca(OH)2]:___________________________________________________________。(3)与盐溶液反应(如CaCl2):___________________________________________________________。(4)与CO2、H2O反应:___________________________________________________________。3.用途碳酸钠是一种重要的化工原料,应用于玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金、食品等工业。
Na2CO3+CaCl2===CaCO3↓+2NaCl
Na2CO3+H2O+CO2===2NaHCO3
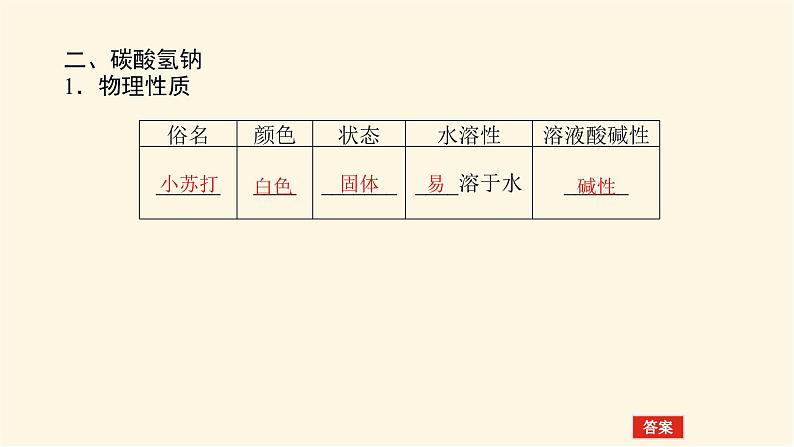
二、碳酸氢钠1.物理性质
2.化学性质(填化学方程式)(1)受热分解:___________________________________________________________。(2)与酸(如盐酸)反应:___________________________________________________________。(3)与碱(如NaOH)反应:___________________________________________________________。3.用途碳酸氢钠用作________、灭火剂,用于治疗________。
NaHCO3+HCl===NaCl+H2O+CO2↑
NaHCO3+NaOH===Na2CO3+H2O
[即时自测]1.判断正误,正确的打“√”,错误的打“×”(1)等物质的量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,生成二氧化碳一样多。( )(2)可用氢氧化钙溶液鉴别碳酸钠与碳酸氢钠。( )
解析:每1 ml碳酸钠和碳酸氢钠分别与足量的盐酸反应都能生成1 ml二氧化碳。
解析:碳酸钠与碳酸氢钠都能与氢氧化钙溶液反应生成沉淀,故不能用氢氧化钙溶液鉴别碳酸钠与碳酸氢钠。
(3)碳酸钠俗称纯碱,它属于碱类物质。( )(4)Na2CO3溶液的碱性强于NaHCO3溶液的碱性。( )
解析:碱是指电离出的阴离子全部是OH-的化合物,碳酸钠虽然俗称纯碱,但其属于盐类。
解析:当比较溶液的碱性强弱时必须强调等浓度。
2.下列物质与Na2CO3溶液不发生化学反应的是( )A.CO2 B.NaOH C.BaCl2 D.稀H2SO4
解析:Na2CO3与NaOH不发生化学反应。
3.(双选)下列实验操作最终可得无色透明溶液的是( )A. 过量CO2通入饱和Na2CO3溶液中B.过量CO2通入澄清石灰水中C.将少量的钠投入到饱和的NaHCO3溶液中D.少量的钠投入到饱和Na2CO3溶液中
4.我国化学家侯德榜改进国外的纯碱生产工艺,生产流程可简要表示如图:下列说法中不正确的是( )A.向饱和食盐水中先通入足量的NH3,再通入足量的CO2B.沉淀池中得到的沉淀为碳酸钠C.使原料氯化钠的利用率从70%提高到90%以上,主要是设计了循环1D.循环2中的气体X为CO2
提升点 Na2CO3和NaHCO3的性质应例 现有两瓶无标签的无色溶液,分别装有Na2CO3溶液和NaHCO3溶液,用下列试剂或方法能将两者区分的是( )①Ca(OH)2 ②盐酸 ③CaCl2 ④NaOH ⑤加热A.①③ B.①④ C.②③ D.②⑤
【解析】 ①④都是碱,加入Na2CO3、NaHCO3中,现象相同(①都有沉淀、④都无明显现象),所以①④不能区分。②向Na2CO3溶液和NaHCO3溶液中加盐酸,产生气泡速率快的是NaHCO3溶液,产生气泡速率慢的是Na2CO3溶液,可以区分。③加入CaCl2时,Na2CO3溶液中有沉淀生成,而NaHCO3溶液中无沉淀生成,可以区分。⑤加热法,因两者都是溶液,加热都不分解,故无法区分。
状元随笔 (1)盐酸逐滴加入到Na2CO3溶液中:①现象:开始无明显现象,后有无色气体放出;②原理:Na2CO3+HCl===NaHCO3+NaCl(无明显现象),NaHCO3+HCl===NaCl+CO2↑+H2O(无色气体放出)。(2)Na2CO3溶液逐滴加入到稀盐酸中:①现象:有无色气体放出;②原理:NaCO3+2HCl===2NaCl+CO2↑+H2O。
[提升] 某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。(1)图Ⅰ、Ⅱ所示实验中能够达到实验目的的是(填装置序号)________。
解析:图Ⅰ不能达到实验目的,因为无论是碳酸钠还是碳酸氢钠均可以与盐酸反应产生二氧化碳,使澄清石灰水变浑浊;图Ⅱ可以达到实验目的,因为等质量的碳酸钠和碳酸氢钠与足量的稀盐酸反应,生成的二氧化碳气体的量不同,可根据气球膨胀程度判断。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为___________________________________________________;与实验Ⅲ相比,实验Ⅳ的优点是(填选项字母)________。A.Ⅳ比Ⅲ复杂B.Ⅳ比Ⅲ安全C.Ⅳ比Ⅲ操作简便 D.Ⅳ可以做到用一套装置同时进行两个实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)________。
解析:试管B中装入碳酸氢钠,试管A中装入碳酸钠,这样直接加热的碳酸钠,温度高,不分解,不能使澄清石灰水变浑浊,而间接加热的碳酸氢钠分解,使澄清石灰水变浑浊,表明碳酸氢钠不稳定。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应,①当石灰水过量时,其化学方程式为___________________________________________________________;②当碳酸氢钠与氢氧化钙的分子数之比为2∶1时,所得溶液中溶质的化学式为________,请设计实验检验所得溶液中溶质的阴离子___________________________________________________________ ____________________________________________________________ 。
Ca(OH)2+NaHCO3===CaCO3↓+NaOH+H2O
解析:石灰水过量时,化学方程式为Ca(OH)2+NaHCO3===CaCO3↓+NaOH+H2O
关键能力Na2CO3和NaHCO3的鉴别、除杂1.鉴别
状元随笔 互滴法可以检验Na2CO3和稀盐酸:互滴法是指当两种物质反应时有两个不同的反应过程,且这两个过程的现象各不相同,则可以通过滴加顺序不同,利用产生现象的不同进行鉴别。
1.(双选)下列说法中正确的是( )A.热的纯碱溶液可以去除物品表面的油污B.在医疗上,小苏打是治疗胃酸过多的一种药剂C.“侯氏制碱法”中的碱指的是烧碱D.Na2CO3和NaHCO3属于盐类,溶液均显中性
解析:“侯氏制碱法”中的碱指的是纯碱,C项错误;Na2CO3、NaHCO3溶液均显碱性,D错误。
2.下列各组物质与其用途不对应的是( )A.过氧化钠:供氧剂B.烧碱:治疗胃酸过多的一种药剂C.小苏打:发酵粉的主要成分D.纯碱:除去物品上的油污
解析:烧碱(NaOH)为强碱,具有强腐蚀性,不能作为药剂治疗胃酸过多。
3.过量的NaHCO3与Na2O2混合,在密闭容器中充分加热后,最后排出气体,残留的物质应是( )A.Na2O和Na2O2 B.Na2O2和Na2CO3C.Na2CO3 D.Na2O
4.下列有关Na2CO3和NaHCO3性质的说法,正确的是( )A.溶解度:Na2CO3>NaHCO3B.下图所示装置可证明稳定性:Na2CO3>NaHCO3C.用澄清石灰水可鉴别Na2CO3溶液和NaHCO3溶液D.等质量的Na2CO3和NaHCO3分别与过量盐酸反应,放出CO2的质量相同
解析:常温下在相同的溶剂中,Na2CO3比NaHCO3易溶,故A正确;NaHCO3受热易分解,要证明热稳定性:Na2CO3>NaHCO3,如图内管中应盛NaHCO3,外管中应盛Na2CO3,故B错误;澄清石灰水与Na2CO3和NaHCO3溶液反应都生成碳酸钙沉淀,现象相同,无法鉴别,故C错误;等物质的量的Na2CO3和NaHCO3分别与过量盐酸反应,产生CO2的质量相同,Na2CO3和NaHCO3的摩尔质量不同,Na2CO3较大,所以相同质量的Na2CO3和NaHCO3,Na2CO3的物质的量较小,与足量盐酸作用时,Na2CO3放出的CO2少,故D错误。
化学必修 第一册第三单元 物质的分散系教课内容ppt课件: 这是一份化学必修 第一册第三单元 物质的分散系教课内容ppt课件,共15页。PPT课件主要包含了物理性质,化学性质,受热易分解产生CO2,弱碱性,与胃酸盐酸反应,侯氏制碱法等内容,欢迎下载使用。
苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物获奖ppt课件: 这是一份苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物获奖ppt课件,共17页。PPT课件主要包含了学习目标,知识回顾,呼吸面具的供氧剂,碳酸钠的性质,新知探究,与酸反应,现象晶体析出,与碱反应,与盐反应,小苏打等内容,欢迎下载使用。
高中苏教版 (2019)第二单元 金属钠及钠的化合物评课ppt课件: 这是一份高中苏教版 (2019)第二单元 金属钠及钠的化合物评课ppt课件,共32页。













